Неравновесные условия кристаллизации твердых растворов
Проведенный анализ процессов, развивающихся при равновесной кристаллизации, позволяет сделать вывод о том, что в условиях реальных скоростей охлаждения кристаллизующегося сплава (в земляной, либо металлической форме, или в кристаллизаторе - при получении слитков), практически всегда будут развиваться диффузионные процессы обмена на межфазной поверхности в течение всего периода кристаллизации и, практически, полностью подавляться гомогенизирующая диффузия внутри растущего твердого кристалла.
Это приведет к нарушению равновесных условий кристаллизации и получению химической неоднородности в конечной структуре литого сплава.
Как было показано выше, нарушение равновесия при кристаллизации твердых растворов обусловлено подавлением диффузионных процессов, которые должны обеспечивать полноту перераспределения компонентов между фазами и внутри каждой из фаз, и, главным образом, внутри растущего твердого кристалла.
Развитие кристаллизации в таких условиях можно проследить по равновесной фазовой диаграмме, учитывая указанные ограничения (рисунок 3.6).
На диаграмме приведена схема кристаллизации в неравновесных условиях, из которой следует, что начальные этапы кристаллизации после переохлаждения ниже температуры ликвидуса практически не отличаются от таких же этапов кристаллизации в равновесных условиях за исключением того, что для образования первого зародыша твердой фазы требуется несколько более высокая степень переохлаждения.
| В неравновесных условиях кристаллизация будет происходить с образованием большего количества одновременно зарождающихся кристаллов, при более высоких скоростях их роста в кинетическом режиме, но в условиях меньшей диффузионной подвижности атомов (более низких температурах превращения). |
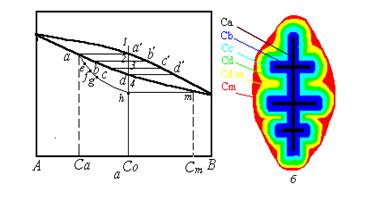 |
| Рисунок 3.6. Схема процессов неравновесной кристаллизации сплавов в системе с неограниченной растворимостью в твердом и жидком состоянии: а - диаграмма фазового равновесия с нанесенной схемой изменения состава фаз при неравновесной кристаллизации; б - схема кристалла с дендритной ликвацией |
Рассматривая кристаллизацию единичного кристалла твердого раствора в этих условиях (рисунок 3.2,а), можно видеть, что при переохлаждении жидкого раствора ниже температуры 1 в расплаве появляется тонкий разветвленный зародыш твердого раствора, соответствующий равновесной концентрации твердой фазы при температуре превращения, определяемой линией солидус равновесной фазовой диаграммы. Для температуры точки 1 состав зародыша соответствует точке а на линии солидус (концентрация Са на рисунок 3.6,б).
Понижение температуры до точки 2, как и в случае равновесной кристаллизации вызовет осаждение на ранее образовавшемся дендритном зародыше нового слоя твердого раствора, концентрация которого будет соответствовать равновесной концентрации Сb (точка b на линии равновесного солидуса).
Возникнув при переохлаждении, такой слой далее не растет в диффузионном режиме, поскольку диффузионные процессы в твердой фазе в условиях эксперимента по неравновесной кристаллизации подавлены. В условиях непрерывного охлаждения по достижении температуры точки 2 можно определить мгновенное значение средней концентрации твердого раствора Се, как
 ,
,
где Ма и Мb - масса закристаллизовавшихся первого зародыша с составом Са и второго слоя с концентрацией Сb.
Точка е, соответствующая такой средней концентрации твердого раствора, оказывается левее линии равновесного солидуса. Это означает, что закристаллизовавшийся твердый раствор оказывается не насыщенным по компоненту В.
Дальнейшее понижение температуры при кристаллизации до точки 3 приводит к появлению нового слоя твердого раствора, кристаллизующегося в кинетическом режиме. Состав такого слоя в связи с высокой скоростью обменных диффузионных процессов на границе раздела фаз соответствует точке равновесного солидуса с - (слой Сс на схеме кристалла - рисунок 3.6,б). Роста слоя в диффузионном режиме, как и предыдущего, не наблюдается в связи с подавлением гомогенизации твердого раствора. Поэтому, к температуре точки (3) растущий кристалл оказывается вновь неоднородным, а средний состав твердой фазы в первом приближении вновь можно определить по выражению, аналогичному вышеприведенному:
 ,
,
где М и С с соответствующими индексами a, b и c - масса и концентрация первого зародыша и двух последовательно нараставших на его поверхность слоев при кристаллизации.
Точка f, соответствующая средней мгновенной концентрации твердой фазы при температуре точки 3 в условиях непрерывного охлаждения Сf, лежит также левее равновесного солидуса фазовой диаграммы, как и точка е, образуя с ней линию изменения среднего состава твердой фазы при неравновесной кристаллизации.
Продолжив рассмотрение кристаллизации при охлаждении до температуры точки 4, можно показать, что только концентрация следующего тонкого слоя, кристаллизующегося в этих условиях, будет иметь концентрацию Сd, численно равную составу сплава, а средний состав твердой фазы по достижении этой температуры вновь не будет соответствовать солидусу равновесной диаграммы. Точка g, определяющая средний состав твердой фазы, при температуре 4 оказывается левее точки d.
Это означает, что при температуре равновесного солидуса сплава в условиях неравновесного ускоренного охлаждения кристаллизация сплава не заканчивается, и в нем содержится кроме закристаллизовавшегося неоднородного по химическому составу кристалла твердой фазы некоторое количество жидкости, которая является неравновесной, поскольку содержит повышенное количество легкоплавкого компонента В, не перераспределившегося в центральные слои кристалла в связи с рассмотренными выше неравновесными условиями кристаллизации.
Кристаллизация такой жидкости должна завершиться в тот момент, когда средняя концентрация твердой фазы при неравновесной кристаллизации станет равной составу сплава, т.е. когда линия изменения среднего состава твердой фазы aefg пересечется с линией фигуративных точек сплава. Это соответствует точке h на линии среднего состава твердой фазы и температуре точки 5. Эта точка является температурой неравновесного солидуса сплава для рассмотренных условий неравновесной кристаллизации.
В этот момент образуется последний внешний слой кристалла, состав которого также определяется точкой на равновесном солидусе, соответствующем температуре окончания кристаллизации. Это концентрация Сm (см. соответствующие точки на рисунках 3.6,а и б).
| Таким образом, по сечению кристалла, формирующегося в условиях неравновесной кристаллизации, возникает химическая неоднородность, которая носит название: внутрикристаллитной или дендритной ликвации. |
Типичными представителями диаграмм с непрерывным рядом твердых и жидких растворов являются системы медь – никель, серебро – золото и некоторые другие.
