Сульфирование комплексными соединениями триоксида серы
Недостаток электронов на атоме серы придаёт молекуле серного ангидрида характер сильной кислоты Льюиса, а избыток электронов на атомах кислорода - основания Льюиса.
В связи с этим серный ангидрид легко вступает в различные химические взаимодействия, в том числе в реакции сульфирования и комплексообразования. Химическая активность серного ангидрида в качестве акцептора в реакциях комплексообразования и сульфирования объясняется атакой кислого атома (S) богатых электронами (основных) систем.
В тех случаях, когда отрицательный заряд локализован на одном из атомов (например, p-электроны гетероатома), присоединение происходит быстро и со значительным выделением тепла. Если отрицательный заряд делокализован, основная реакция сопровождается протеканием различных побочных процессов.
С органическими основаниями серный ангидрид реагирует как кислота Льюиса, образуя стабильные аддукты:
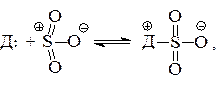
где Д - основание (донор электронов).
Систематическое исследование строения и реакционной способности комплексных соединений SO3 было проведено в Ленинградском химико-фармацевтическом институте (теперь Санкт-Петербургская химико-фармацевтическая академия) под руководством профессора Б.В. Пассета. Было показано, что комплексные соединения серного ангидрида относятся к комплексам с переносом заряда и подчиняются общим закономерностям, сформулированным для комплексов этого типа в работах Е.Н. Гуряновой с сотрудниками.
Комплексы серного ангидрида с простыми эфирами и триалкилфосфатами являются достаточно прочными и устойчивыми. Величина степени переноса в этих соединениях свидетельствует о том, что к атому серы переходит до 0,8 заряда электрона от атома кислорода донорных молекул. Такая значительная степень переноса заряда приводит к тому, что молекула SO3 в комплексах становится некомпланарной, что подтверждается как результатами квантово-механических расчётов, так и данными КР- и ИК-спектров. Диоксан и пиридин могут присоединять от 1 до 3 молей SO3.
Оказалось, что тепловой эффект присоединения второй молекулы триоксида серы (171,3 кДж/моль) лишь немного меньше теплоты присоединения первой молекулы (175,4 кДж/моль), что свидетельствует в пользу структуры
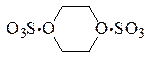
а не структуры
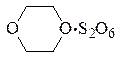
которая предполагалась рядом авторов. Тепловой эффект присоединения третьей молекулы SO3 составляет лишь 11,7 кДж/моль.
Наиболее устойчивыми и наименее реакционноспособными являются комплексные соединения, в которых донором электронов выступает атом азота (пиридин и третичные амины).
Комплексы серного ангидрида характеризуются специфичной устойчивостью и реакционной способностью, которые зависят от основности и строения комплексообразователей, а также от свойств среды и ряда других факторов. На практике их в основном используют в качестве сульфирующих агентов для ацидофобных субстратов.
Комплексы NAlk3.SO3 в неводных растворах практически недиссоциированы. Поэтому для успешного проведения реакции во многих случаях требуется дополнительное введение веществ, способствующих поляризации комплекса и активации субстрата.
