Ионное произведение воды. Водородный показатель
Занятие 5. Водородный показатель. Гидролиз солей.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Соединения, водные растворы которых способны проводить электрический ток называются электролитами. Электролиты проводят ток за счет образования ионов, этой способностью обладают многие соединения с ионным строением (соли, кислоты, основания).
Кислота ↔ m Н+ + Кисл. остаток m—
Основание ↔ Ме n+ + n ОН —
Соль ↔ Ме n+ + Кисл.остаток m—
Процесс распада электролитов на ионы при растворении или расплавлении называется электролитической диссоциацией.
Сильные электролиты распадаются на ионы полностью. В растворах слабых электролитов одновременно с ионами существуют молекулы. Для определения силы электролитов следует помнить:
Кислоты. К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Почти все остальные кислоты – слабые электролиты.
Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов. Слабый электролит – NH3, а также все нерастворимые основания.
Соли. Большинство распространенных солей – ионных соединений, — электролиты сильные. Исключения составляют, в основном, соли тяжелых металлов.
Ионное произведение воды. Водородный показатель.
Вода, являясь электролитом, в незначительной степени диссоциирует (распадается) на ионы Н+ и ОН—, которые находятся в равновесии с недиссоциированными молекулами:
Н2О ↔ Н+ + ОН— (1)
Равновесную концентрацию ионов обычно обозначают с помощью квадратных скобок [ ] и выражают в молях ионов в 1 л раствора. Как видно из уравнения диссоциации воды (1), в ней концентрации ионов Н+ и ОН— одинаковы. Опытом установлено, что в 1 л воды при комнатной температуре (22° С) диссоциации подвергаются лишь 10-7 моль и при этом образуется 10-7 моль/л ионов Н+ и 10-7 моль/л ионов ОН- (гидроксид-ионов).
Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре Кв — величина постоянная. Численное значение его при 22° С равно 10-14:
Кв = [Н+] [ОН —] = 10-7 × 10-7 = 10-14 (2)
Постоянство произведения [Н+] [ОН —-] означает, что в любом водном растворе содержатся как Н + -ионы, так и гидроксид-ионы ОН—-. А так же, что при уменьшении концентрации одного из ионов воды соответственно увеличивается концентрация другого иона.
Таким образом, кислотность и щелочность раствора можно выражать через концентрацию либо ионов Н+, либо ионов ОН—. На практике пользуются первым способом. Тогда для нейтрального раствора [Н+]=10-7, для кислого [Н+] > 10-7 и для щелочного [Н+] < 10-7 моль/л.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН (читается «пэ-аш») (от лат. pondus Hydrogenii — «вес водорода»). Понятие «водородный показатель» было введено датским химиком С. Сёренсеном в 1909 г
Водородным показателем рН называется десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
рН = —-lg[H+] (5)
где [Н+] — концентрация ионов водорода, моль/л.
С помощью рН реакция растворов характеризуется так: нейтральная рН 7, кислая рН<7, щелочная рН>7.
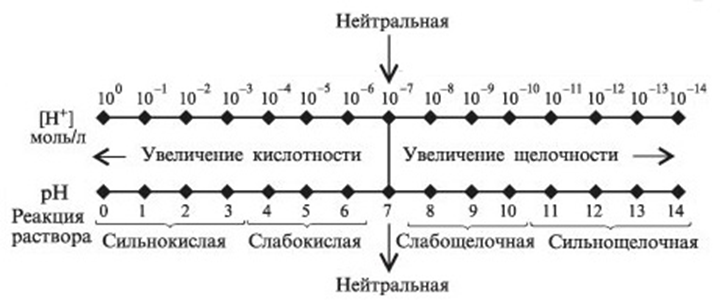
Значение водородного показателя среды
Многие производственные процессы в химической, пищевой, текстильной и других отраслях промышленности протекают лишь при определенной реакции среды. В фотохимии среда раствора влияет на:
1. Скорость протекания химических процессов
2. Химическое созревание фотоэмульсии
3. Механизм дубления фотоэмульсии
Способы определения водородного показателя
1. Качественно кислотность или щелочность среды определяют с помощью обычных индикаторов (лакмус, фенолфталеин, метиловый оранжевый).
2. Примерное значение можно определить при помощи универсальной индикаторной бумаги.
3. Точные инструментальные методы определения рН — с помощью прибора рН-метра.
Гидролиз солей.
Гидролиз солей можно представить, как взаимодействие ионов соли молекулами воды, приводящее к образованию слабого электролита. С молекулами воды взаимодействует ион, принадлежащий слабому электролиту Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na+ + Cl—
2. Соли, образованные слабым основанием и сильной кислотой
Гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4+ + Cl—
NH4+ + HOH ↔ NH4OH + H+
Суммарное NH4Cl+ HOH ↔ NH4OH + HCl
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe 2+ + 2Cl —
I ступень Fe 2+ + HOH ↔ (FeOH)+ + H+
Суммарное FeCl2 + HOH ↔ (FeOH)Cl + HCl
II ступень (FeOH)+ + HOH ↔ Fe(OH)2 + H+
Суммарное (FeOH)Cl + HOH↔ Fe(OH)2 + HCl
3. Соль, образованная сильным основанием и слабой кислотой
Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na+ + CN—
CN— + HOH ↔ HCN + OH—
Суммарное NaCN + HOH ↔ HCN + NaOH
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
Na2SO3 ↔ 2Na+ + SO32-
I ступень SO32- + HOH ↔ HSO3— + OH—
Na2SO3 + HOH ↔ NaHSO3 + NaOH
II ступень HSO3— + HOH ↔ H2SO3 + OH—
NaHSO3 + HOH ↔ H2SO3 + NaOH
4. Соли, образованные слабым основанием и слабой кислотой
Гидролиз протекает как по катиону, так и по аниону. Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S↑
Влияние различных факторов на протекание гидролиза:
Фотографические смеси часто рекомендуют готовить перед применением, растворять в холодной воде. При необходимости сохранять растворы - хранить их в прохладном месте. Эти требования связаны с гидролизом, который соответствии с принципом Ле-Шателье, усиливается при повышении температуры и при разбавлении растворов.
