Ионное произведение воды. Водородный показатель
Химически чистая вода является очень слабым электролитом, т.к. весьма незначительная часть ее молекул диссициирована на ионы:
H2O ↔ H+ + OH-.
При постоянной температуре произведение молярных концентраций ионов H+ и OH- в воде и разбавленных водных растворах остается постоянным. Это произведение называют ионным произведением воды и при 250С оно равно 10-14:

где 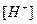 и
и 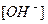 - молярные концентрации ионов H+ и OH- соответственно.
- молярные концентрации ионов H+ и OH- соответственно.
Это важная постоянная, которая позволяет по значению 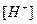 найти
найти 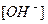 и наоборот.
и наоборот.
Концентрация ионов H+ в воде и разбавленных водных растворах очень мала. Поэтому для удобства расчетов используют водородный показатель pH, который равен отрицательному десятичному логарифму концентрации ионов водорода в растворе:

Следовательно

Значение водородного показателя и характер среды представлены в таблице 1.
Таблица 1. Водородный показатель и характер среды.
| Значение pH | Характер среды | Соотношение ионов |
| 1˂pH˂7 | кислая | [H+]>[OH-], [H+]>10-7 моль/л |
| pH = 7 | нейтральная (химически чистая вода) | [H+] = [OH-] = 10-7 моль∕л |
| 7˂pH˂14 | щелочная | [H+]<[OH-], [H+-]<10-7 моль/л |
Для определения характера среды применяют индикаторы – вещества, изменяющие свою окраску в зависимости от концентрации катиона водорода. Окраска некоторых индикаторов представлена в таблице 2.
Таблица 2. Окраска некоторых индикаторов
| Индикатор | Окраска в кислой среде | Окраска в щелочной среде |
| Фенолфталеин Метилоранж Универсальный | Бесцветная Красная Красная | Малиновая Желтая Синяя |
С помощью универсального индикатора можно приблизительно (с точностью до единицы) оценить величину pH раствора. Точное значение pH (до 0,01 единицы) измеряют с помощью прибора pH-метра.
В организме человека pH крови составляет примерно 7,4, желудочный сок имеет pH = 1-2, pH морской воды находится в интервале 7,6 – 8,4, растворов моющих средств – в интервале 12-14, котловая вода pH = 10.
Гидролиз солей
Гидролиз– это взаимодействие соли с водой, которое приводит к образованию слабого электролита и изменению характера среды. Соли являются продуктами взаимодействия кислот и оснований между собой. Соли – сильные электролиты, в водных растворах они полностью диссоциированы. Если один из ионов соли способен реагировать с водой с образованием слабого электролита, то в растворе появляется избыток свободных катионов водорода H+ или гидроксильных групп OH-, изменяется характер среды (pH#7), происходит гидролиз. Взаимодействуют с водой с образованием слабого электролита катионы слабых оснований и анионы слабых кислот.
По отношению к гидролизу соли делятся на четыре группы в зависимости силы основания и кислоты, образующих соль.
1.Соли сильного основания и сильной кислоты гидролизу не подвергаются (оба иона образуют с водой сильные электролиты). Растворы таких солей нейтральны (pH=7):
NaCl + HOH≠
2.Соли сильного основания и слабой кислоты создают в растворе щелочную среду(pH>7). Анион слабой кислоты образует с водой слабый электролит, идет гидролиз по аниону:
CO32- + HOH ↔ HCO3- + OH- - ионное уравнение гидролиза.
Na2CO3 + HOH ↔ NaHCO3 + NaOH – молекулярное уравнение гидролиза;
3. Соли сильной кислоты и слабого основания создают в растворе кислую среду (pH<7). Катион металла образует с водой слабый электролит, идет гидролиз по катиону:
Zn2+ + HOH ↔ ZnOH+ + H+ - ионное уравнение гидролиза.
ZnCl2 + HOH ↔ ZnOHCl + HCl – молекулярное уравнение гидролиза;
4. Соли слабой кислоты и слабого основания сильно гидролизуются. Характер среды близок к нейтральной (pH≈7) и зависит от соотношения силы кислоты и основания, образующих данную соль.
Соли очень слабых (амфотерных) оснований и очень слабых кислот подвергаются полному гидролизу, т.е. разлагаются на основание и кислоту:
Al2S3 + 3H2O = 2Al(OH)3↓ + 3H2S↑
Таким образом, если кислота и основание, образующие соль, отличаются по силе, раствор соли имеет ту же среду, что и сильный электролит.
Для определения характера среды в растворе соли удобно пользоваться таблицей 3.
Таблица 3.Характер среды в растворах солей.
| Основание | Кислота | pH раствора соли |
| сильное | сильная | pH=7 (нейтральная среда) |
| сильное | слабая | pH>7 (щелочная среда) |
| слабое | сильная | pH<7 (кислая среда) |
| слабое | слабая | pH≈7 (близкая к нейтральной среда) |
Гидролиз – обратимый процесс. Гидролиз усиливается (равновесие сдвигается вправо), при повышении температуры и уменьшении концентрации соли, т.е. при разбавлении раствора.
