Вопрос 22 Ароматические амины
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его p-электронами.
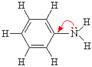 Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет. Таким образом, основные свойства изменяются в ряду: C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет. Таким образом, основные свойства изменяются в ряду: C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
II. Окисление аминов
Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени. 4СH3NH2 + 9O2 ® 4CO2 + 10H2O + 2N2 III. Взаимодействие с азотистой кислотой Азотистая кислота HNO2 – неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой: KNO2 + HCl ® НNO2 + KCl
или NO2- + H+ ® НNO2
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
· Первичные алифатические амины c HNO2 образуют спирты: R-NH2 + HNO2 ® R-OH + N2 + H2O
· Первичные ароматические амины при повышенной температуре реагируют аналогично, образуя фенолы. При низкой температуре (около 0° С) реакция идет иначе (см. ниже, раздел 2.4).
· Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в нитрозосоединения (вещества с характерным запахом): R2NH + H-O-N=O ® R2N-N=O + H2O
алкилнитрозамин
· Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
Анилин Анилин (фениламин, аминобензол) С6H5NH2 – важнейший из ароматических аминов: Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты). Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом, т.кип. 184° С, т.пл. -6° С. Ядовит. Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком. С другой стороны, бензольное кольцо под влиянием аминогруппы становится более активным в реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок) : 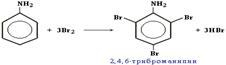 Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре). Такое взаимное влияние атомов в молекуле анилина объясняется сопряжением p-электронов бензольного кольца с неподеленной электронной парой атома азота (+M-эффект аминогруппы):
Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре). Такое взаимное влияние атомов в молекуле анилина объясняется сопряжением p-электронов бензольного кольца с неподеленной электронной парой атома азота (+M-эффект аминогруппы): 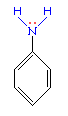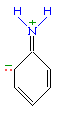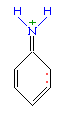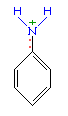 Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений. 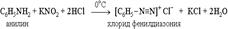 При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол: 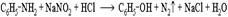
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины. Получение аминов ВОРОС 211. Нагревание галогеналканов с аммиаком: 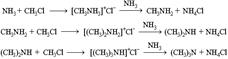 В основе этих превращений лежит реакция нуклеофильного замещения галогена в галогеналканах. Роль нуклеофила играют молекулы аммиака и аминов, имеющие неподеленную пару электронов на атоме азота. 2. Первичные амины получают восстановлением нитросоединений:
В основе этих превращений лежит реакция нуклеофильного замещения галогена в галогеналканах. Роль нуклеофила играют молекулы аммиака и аминов, имеющие неподеленную пару электронов на атоме азота. 2. Первичные амины получают восстановлением нитросоединений: 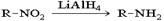 Важнейший ароматический амин – анилин – образуется при восстановлении нитробензола:
Важнейший ароматический амин – анилин – образуется при восстановлении нитробензола:  Эта реакция носит имя русского химика Зинина осуществившего ее впервые в 1842 г.
Эта реакция носит имя русского химика Зинина осуществившего ее впервые в 1842 г.
Вопрос 25.
