Концентрированной азотной кислотой
а) Налить в две пробирки по 5 капель 2 н раствора азотной кислоты. Внести в одну пробирку кусочек железной стружки, в другую - кусочек меди. Слегка нагреть обе пробирки. Какой газ выделяется? Добавить в первую пробирку одну каплю 0,01 н раствора роданида калия, который образует с ионами Fe3+ соль Fe(SCN)3, интенсивно окрашенную в красный цвет. Почему при растворении железа в азотной кислоте образуются ионы Fe3+ (а не Fe2+)? Появились ли ионы меди в растворе второй пробирки?
б) Слить разбавленную кислоту, оставив кусочки металлов в пробирках, и внести в пробирки по 5-6 капель концентрированной азотной кислоты. Реагирует ли железо с концентрированной азотной кислотой на холоду? Почему? Какие еще металлы пассивирует концентрированная азотная кислота? Какой газ выделяется в пробирке с медью? В уравнениях реакций указать окислитель и восстановитель.
Опыт 6. (Проводить в вытяжном шкафу).
Взаимодействие металлов с разбавленной и концентрированной серной кислотой
В две пробирки налить по 4-5 капель 2 н раствора серной кислоты. В одну пробирку опустить кусочек цинка, в другую - кусочек меди и слегка подогреть. Какой газ выделяется в первой пробирке? Почему не появилось сине-голубого окрашивания во второй пробирке? То же проделать с концентрированной серной кислотой. Обратить внимание на резкий запах выделяющегося диоксида серы S02. Почему разбавленная и концентрированная серная кислота по-разному действует на металл?
Опыт 7. Взаимодействие Металлов со щелочами
В одну из пробирок с 5-10 каплями 2 н раствора щелочи опустить кусочек алюминия, в другую - кусочек цинка. Обе пробирки слегка подогреть на водяной бане. Наблюдать выделение водорода. Составить уравнения реакций, учитывая, что получаются соответствующие гидроксокомплексы (координационное число алюминия и цинка равно 4).
Какие еще металлы способны растворяться в щелочах?
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Каковы особенности электронного строения атомов металлических элементов? Чем объясняется относительно слабая связь валентных электронов атомов металлов с ядром?
2. Каково положение металлов в периодической системе элементов? Как изменяются окисительно-восстановительные свойства элементов по периоду, группе?
3. Чем обусловлены характерные физические свойства металлов? От чего они зависят?
4. Что представляет собой металлическая связь?
5. Какие металлы нельзя хранить на воздухе? Почему? Написать уравнения реакций. Как называются получающиеся соединения?
6. Какие металлы, устойчивы к окислению кислородом воздуха? Почему?
7. Каков характер оксидов металлов? Как он меняется в периоде с увеличением порядкового номера элемента?
8. Как зависит характер оксидов металла от валентности элемента, образующего эти оксиды?
9. Какие металлы взаимодействуют со щелочами? Каков механизм этого процесса?
10. От чего зависит способность металлов растворяться в кислотах?
11. Что называется пассивацией? Когда она наблюдается? Привести примеры.
12. Почему разбавленная и концентрированная серная кислота по-разному действует на металлы?
13. В каких кислотах не растворяется свинец? Чем это объясняется?
14. Какие кислоты не действуют на железо, алюминий, хром? Почему?
15. В каких кислотах растворяется медь? Привести уравнения реакций.
16. Написать уравнения растворения цинка: а) в соляной кислоте; б) в серной кислоте (концентрированной и разбавленной); в) в азотной кислоте (концентрированной и разбавленной); г) в щелочи.
17. Написать уравнения реакций между алюминием и раствором гидроксида натрия с образованием в одном случае тетрагидроксоaлюмината натрия, а в другом – гексагидроксоaлюмината натрия.
18. Закончить составление следующих уравнений:
а) Hg + НNО3(конц) =
б) Hg + НNО3 (разб.) =
в) Mg + НNО3 (разб.) =
г) Mg + НNО3 (конц.) =
д) Ве + КОН =
е) РЬ + КОН + Н20 =
ж) Fe + H2S04 (конц.) =
з) Ag + H2S04 (конц.) =
ЛАБОРАТОРНАЯ РАБОТА №2
КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
Цель работы: ознакомиться с коррозионными процессами металлов и наиболее важными методами защиты металлов от коррозии.
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуют продукты, состав которых зависит от условий коррозии.
Коррозия протекает с уменьшением энергии Гиббса, поэтому является процессом самопроизвольным и необратимым.
Безвозвратные потери от коррозии составляют до 15 % от ежегодного производства металлов. Цель борьбы с коррозией – это сохранение ресурсов металлов, мировые запасы которых ограничены. Изучение коррозии и разработка методов защиты металлов от нее представляют теоретический интерес и имеют большое народно-хозяйственное значение.
По механизму протекания коррозионного процесса, зависящему от характера внешней среды, с которой взаимодействует металл, различают химическую и электрохимическую коррозию.
Химическая коррозияхарактерна для сред, непроводящих электрический ток. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах; б) коррозию в неэлектролитах – агрессивных органических жидкостях.
Коррозия в неводных средах наблюдается при эксплуатации химико-технологического оборудования. Сами по себе чистые углеводороды не разрушают металлы. Их коррозионное действие обусловлено примесями атомов серы, хлора, азота и при повышенных температурах возможны реакции
2R - Cl + Me → МеСl2 + R-R;
R1- S - R2 + Me → Ме S + R1 - R2,
где R – органические радикалы.
Наиболее частый результат газовой коррозии – это образование на поверхности металлов оксидов. Химическое сродство большинства металлов к кислороду неограниченно, так как оксиды всех технически важных металлов способны растворятся при высокой температуре в металлах и уходить из равновесной системы:
t0 C
2Me (т) + O2 (г) ← → 2MeO(т)
t0C
MeO(т) → [ MeO]раствор в Ме
В этих условиях окисление всегда возможно. Но наряду с растворением оксида, будет образовываться и оксидная пленка на поверхности металла. Если эта пленка прочна, компактна и хорошо сцепляется с поверхностью металла, то она сообщает металлу некоторую пассивность при низкой температуре, так как затрудняет доступ кислорода к его поверхности. Такого рода оксидные пленки образуются в сухом воздухе на бериллии, алюминии, хроме, титане и других металлах.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя.
В электропроводной жидкости (растворы солей, кислот, оснований, почвенная вода, пленка адсорбированной воды, содержащей растворенные газы CO2 SO2, O2, вода в резервуарах, морская вода и т. д.) коррозионно опасными к конструкциях окажутся:
– места контактов металлов с различными потенциалами;
– неоднородные металлические сплавы;
– участки с различной концентрацией электролитов или воздуха, растворенного в жидком электролите;
– контакт в одном изделии участков, подвергшихся различной термической или механической обработке.
Во всех перечисленных и во многих других случаях на поверхности металлических конструкций самопроизвольно возникает огромное число локальных микрогальванческих элементов - гальванопар. Участки с меньшим потенциалом окажутся анодами и начнут растворяться, а на катодах, имеющих больший потенциал, будет происходить восстановление ионов или молекул среды, что замедлит или полностью прекратит их собственную коррозию. Окислителями при коррозии служат молекулы кислорода O2, хлора Cl2, ионы Н+, Fe3+, NO3- и др.
Электрохимическая коррозия железа в контакте с никелем в среде электролита – серной кислоты – приведена на рис.1.
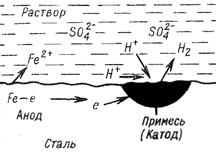
Рис.1. – Схема электрохимической коррозии железа в контакте с никелем в среде электролита – серной кислоты.
В данном случае коррозия обусловлена работой микрогальванических элементов
А (–)Fe│H2SO4│Ni(+) К
Железо как металл с меньшим значением стандартного электродного потенциала, является анодом и, соответственно, окисляется
А(–) Fe – 2ē → Fe2+.
На катодных участках (никель) происходит восстановление окислителя – ионов водорода
К(+) 2Н+ + 2ē → Н2.
В процессе коррозии электроды гальванопары поляризуются, вследствие перехода электронов с анода на катод. Поляризация заключается в сближении потенциалов катода, который понижается и анода, который повышается, что приводит к замедлению (а в пределе к полному прекращению) коррозии. Процесс катодного восстановления, повышающий потенциал катода, является деполяризацией. Поэтому коррозия с участием ионов водорода называется коррозией с водородной деполяризацией (см. рис.1).
Однако наиболее распространена коррозия с кислородной деполяризацией. Примером является электрохимическая коррозия углеродистой стали в нейтральной или слабощелочной среде. На ее поверхности образуются микрогальванические элементы
А(–)Fe│ O2 ,H2O│Fe3С (+) К,
в которых роль катода выполняют кристаллики цементита (Fe3С), а анода – кристаллики железа (Fe). Процессы на электродах протекают следующим образом:
А(–) 2Fe – 4е- →2Fe2+
К(+) O2 + 2H2O + 4е- → 4OH-.
Стальная пластинка начнет корродировать. Освободившиеся электроны, переходя на микрокатоды, восстанавливают кислород с образованием гидроксильных ионов. В нейтральных или слабощелочных средах концентрация ионов водорода очень мала и преимущество получает кислород, молекулы которого «захватывают» электроны. На микроанодах положительные ионы железа (II) переходят в воду, и, взаимодействуя с ионами гидроксила, образуют продукт коррозии Fe (OH)2,
2Fe2+ + 4OH- = 2 Fe (OH)2.
Кислород, растворенный в воде, быстро окисляет гидроксид железа(II) в гидроксид железа(III) по реакции
4Fe (OH)2 + O2 + 2H2O → 4Fe (OH)3
В результате частичной дегидратации гидроксида железа(III) (отщепления воды) образуется ржавчина (FeхOу ∙n H2O) или
4Fe (OH)3 → FeOOH + H2O.
ржавчина
Как видно, основным отличием электрохимической коррозии от процессов, протекающих в гальванических элементах является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла. Химическая энергия реакции окисления металла передается не в виде работы, а лишь в виде теплоты.
Особым видом электрохимической коррозии является коррозия за счет внешнего электрического тока.
Наибольший вред наносит коррозия металлам с неоднородной поверхностью и с различными примесями.
В этом случае наряду с химическими процессами (отдача электронов) протекают электрические процессы (перенос электронов от одного участка к другому).
Скорость коррозии тем больше, чем дальше в ряду стандартных электродных потенциалов расположены те металлы, из которых образовалась гальваническая пара.
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т.е. меньше рН), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Защита от коррозии.Выбор способа защиты металлических изделий от коррозии определяется его эффективностью, а также экономической целесообразностью. Все методы защиты условно делятся на следующие группы: а) легирование металлов; б) защитные покрытия (металлические и неметаллические); в) электрохимическая защита; г) изменение свойств коррозионной среды; д) рациональное конструирование изделий.
Легирование металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. В качестве таких компонентов применяют хром, никель, алюминий и др. Введение некоторых добавок к сталям (титана, меди, хрома и никеля) приводит к тому, что при коррозии образуются плотные продукты реакции, предохраняющие сплав от дальнейшей коррозии.
Защитные покрытия – слои, искусственно создаваемые на поверхности металлических изделий и сооружений для защиты их от коррозии. Выбор вида покрытия чаще всего зависит от условий, в которых используется металл.
Металлические покрытия. Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, серебро и др.), так и их сплавы (латунь, бронза). По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные. К катодным относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве примеров катодных покрытий стальных изделий можно привести медь, никель, серебро. При повреждении покрытия (или наличии пор) возникает коррозионный элемент, в котором основной материал служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия может служить цинк на стальных изделиях. В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует. Потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия.
Неметаллические защитные покрытия могут быть как органическими, так и неорганическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий применяются неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
Электрохимическая защита. Этот метод основан на торможении анодных или катодных реакций коррозионного процесса. Электрохимическая защита осуществляется присоединением к защищаемой конструкции металла с более отрицательным значением электродного потенциала – протектора, а также катодной (катодная защита) или анодной (анодная защита) поляризацией за счет извне приложенного тока. Наиболее применима электрохимическая защита в коррозионных средах с хорошей ионной проводимостью. Катодная защита используется для защиты от коррозии подземных трубопроводов, кабелей; ее также применяют к шлюзовым воротам, подводным лодкам, водным резервуарам и пр.
Сущность катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, поэтому оно становится катодом, а анодом служит вспомогательный, обычно стальной электрод, который растворяется
Mе – nē → Mеn+,
а на защищаемом сооружении (катоде) выделяется водород
2Н2О + 2ē → Н2 + 2ОН–.
При протекторной защите к изделию соединительным проводом присоединяют металл или сплав, потенциал которого значительно отрицательнее потенциала металла изделия – протектор. В качестве материала протекторов используют сплавы алюминия, магния и цинка. В коррозионной среде, например в морской воде, металл протектора растворяется
Zn – 2ē → Zn2+,
а на изделии выделяется водород:
2Н2О + 2ē → Н2 + 2ОН–.
Изменение свойств коррозионной среды. Для снижения агрессивности среды уменьшают концентрацию компонентов, опасных в коррозионном отношении. Например, в нейтральных средах обычно протекает коррозия с поглощением кислорода. Его удаляют деаэрацией или восстанавливают с помощью соответствующих восстановителей (гидразин, сульфиты и т.п.). Агрессивность среды может уменьшаться также при снижении концентрации ионов водорода. Для защиты от коррозии широко применяют ингибиторы – вещества, при добавлении которых в небольших количествах в среду, где находится металл, значительно уменьшается скорость коррозии металла. Ингибиторы применяют главным образом в системах, работающих с постоянным или мало обновляемым объемом раствора.
Механизм действия значительного числа ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении анодных или катодных процессов.
Рациональное конструирование изделий должно исключать наличие или сокращать число и размеры особо опасных, с точки зрения коррозии, участков в изделиях или конструкциях, а также предусматривать специальную защиту металла этих участков от коррозии.
Оборудование и реактивы:штатив с пробирками, 2 н растворы H2SO4, NaCl, MgCl2, NaOH, HCl, K3[Fe(CN)6], насыщенный растворNH4Cl, дистиллированная вода, железные гвозди, медная пластинка,чистые цинк, магний, наждачная бумага, пластины оцинкованного и луженого железа; электролит состава: NiSO4∙7H2O – 10 г/л, H3PO4 – 10 г/л, NaCl – 15 г/л, никелевая и медная пластинки.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Удаление защитной пленки с металла
Для проведения опыта взять две стеклянные пробирки, в каждую внести 1,5-2,0 мл дистиллированной воды и несколько крупинок металлического магния. Почему магний в этих условиях не взаимодействует с водой?
В одну из пробирок добавить 6 капель насыщенного раствора хлорида аммония NH4Cl. Объяснить активное растворение магния в этой пробирке. Записать уравнения протекающей реакции.
Опыт 2. Влияние образования микрогальванических элементов на протекание химических процессов
Внести в пробирку 5-6 капель раствора 2 н серной кислоты и кусочек чистого цинка. Обратить внимание на медленное выделение водорода. Взять медную пластинку, очистить ее наждачной бумагой, внести в раствор и прикоснуться к кусочку цинка. Что наблюдается? Объяснить результаты опыта. Какая образуется гальваническая пара? Какаи процессы происходят на электродах?
Опыт 3. Катодные и анодные защитные металлические покрытия
Две пробирки заполнить наполовину дистиллированной водой, добавить по 2-3 капли 2 н раствора серной кислоты и гексацианоферрата (III) калия K3[Fe(CN)6] – качественного реактива на ионы железа (II), растворы перемешать. В одну пробирку опустить полоску оцинкованного железа (железа, покрытого цинком), в другую – полоску луженого железа (железа, покрытого оловом). Через 1–2 мин. наблюдать изменение окраски раствора в пробирке с луженым железом. Синий цвет раствора обусловлен появлением в растворе ионов железа (II), которые с гексацианоферратом (III) калия образуют турнбулеву синь Fe4[Fe(CN)6]3. Почему цвет раствора в пробирке с оцинкованным железом остался без изменения? Составить схемы электрохимической коррозии, протекающей в обеих пробирках.
Опыт 4. Коррозия железа в различных электролитах
Для проведения опыта подготовить 5 стеклянных пробирок, наполовину заполненных 2 н растворами следующих электролитов: 1 – дистиллированной водой; 2 – водным раствором NaCl; 3 – водным раствором MgCl2; 4 – водным раствором NaOH; 5 – водным раствором HCl. В каждую из пробирок добавить 2-3 капли гексацианоферрата (III) калия и поместить железную пластину (или гвоздь). Объяснить происходящие процессы; сравнить интенсивность коррозии железа в различных средах; записать уравнения коррозионных процессов. Выводы оформить в виде таблицы.
| Коррозионная среда | Индикатор коррозии железа | Окраска раствора с железной пластиной | Уравнения коррозионных процессов |
Опыт 5. Протекторная защита стали
В два стеклянных стаканчика налить по 10 мл разбавленной (~10%) серной кислоты и по 2-3 капли гексацианоферрата (III) калия. В один стаканчик опустить стальную пластинку, в другой – стальную пластинку, соединенную металлическим проводником с цинковой пластинкой. Объяснить коррозию железа в одном из стаканчиков и ее отсутствие в другом.
Опыт 6. Нанесение гальванического покрытия.
Никелирование меди
Никелирование проводят в кислых растворах при рН = 5-5,5 в электролизере, заполненным раствором электролита следующего состава: NiSO4∙7H2O – 100 г/л, H3PO4 – 10 г/л, NaCl – 15 г/л. Фосфорная кислота в электролите поддерживает необходимую для никелирования кислотность. Ионы Cl– , адсорбируясь на поверхности никеля, препятствуют образованию оксидных пленок, тем самым предотвращают пассивацию анода.
Растворимый никелевый анод и предварительно обезжиренный и промытый водой медный катод опустить в электролизер. Подсоединить электроды металлическим проводником к источнику постоянного тока. Оптимальная плотность тока при никелировании составляет 1–2 А/дм2, температура 25-300С. Наблюдать осаждение никелевой пленки на медном катоде. Время электролиза 15 минут. После электролиза покрытую никелем пластинку промыть холодной водой. Записать уравнения реакций, протекающих на электродах. Почему на аноде не выделяются газообразные продукты окисления?
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1.Что такое коррозия металлов? Классифицировать коррозию по механизмам ее протекания.
2. Охарактеризовать сущность электрохимической коррозии.
3. Что такое гальванические микроэлементы? Какие процессы протекают по анодному и катодному механизмам при коррозии в кислой и нейтральной средах.
4. Что такое кислородная и водородная деполяризация?
5.От каких факторов зависит скорость коррозии?
6.Почему в железной бочке можно хранить сильно концентрированную и нельзя хранить разбавленную серную кислоту?
7.Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. После высыхания капли в ее центре появляется пятно ржавчины. Чем это можно объяснить? Какой участок металла, находящийся под каплей воды, является анодным и какой – катодным? Составьте уравнения соответствующих процессов.
8.Перечислить известные методы защиты металлов от коррозии. Чем следует руководствоваться при их выборе?
9.В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов.
10.Напишите уравнения электродных реакций, протекающих при катодной защите стальных труб.
ЛАБОРАТОРНАЯ РАБОТА 3
ЭКВИВАЛЕНТ И МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТОВ
Цель работы: освоить методику экспериментального определения молярной массы эквивалентов металлов и сложных веществ.
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалента одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Так же, как молекула, атом или ион, эквивалент безразмерен. И так же, как в случае молекул, атомов или ионов, состав эквивалента выражают с помощью знаков и формул.
Для того, чтобы определить состав эквивалентов вещества и правильно записать химическую формулу, надо исходить из конкретной реакции, в которой участвует данное вещество.
Рассмотрим несколько примеров определения формулы эквивалента:
а) Zn + 2HCl = ZnC12 + Н2
В данной окислительно-восстановительной реакции участвует два электрона. На один электрон приходится
1/2Zn + НСl = 1/2ZnCl2 + 1/2Н2
т.е. одному электрону соответствует 1/2 атома Zn, одна молекула HСl, 1/2 молекулы ZnCl2 и 1/2 молекулы Н2.
Отсюда Э(Zn) = 1/2Zn; Э(НСl) = HCl; Э(ZnСl2) = 1/2ZnCl2;
Э(Н2)= 1/2Н2.
б) 2NaOH + H2S04 = 2H2O + Na2S04
В данной ионообменной реакции участвует два иона водорода. На один ион водорода приходится
NaOH + 1/2H2SО4 = H2O + 1/2Na2SО4
Поэтому Э(NаОН) = NaOH; Э(Н2S04) = 1/2H2S04, Э(Н2О) = H2О;
Э(Nа2S04) = 1/2Na2S04.
в) NaOH + H2S04 = H2O + NaHS04
В данной ионообменной реакции участвует один ион водорода, поэтому Э(NаОН) = NaOH; Э(Н2S04) = H2S04, Э(Н2О) = H2О;
Э(Nа HS04) = Na HS04
г) Ca(OH)2 + HCl = CaOHCl + H2O
В реакции ( г) участвует один ион водорода, поэтому Э(Са(OH)2) = Са(OH)2; Э(НСl) = НСl; Э(CaOHCl) = CaOHCl; Э(Н2О) = H2О.
д) Ca(OH)2 + 2HCl = CaCl2 + 2H2O
В реакции (д) участвует два иона водорода. На один ион водорода приходится
1/2 Ca(OH)2 + HCl = 1/2CaCl2 + H2.
Отсюда Э(Са(OH)2) = 1/2 Ca(OH)2 ; Э(НСl) = НСl; Э(CaCl2) = 1/2CaCl2; Э(Н2О) = H2О.
Единицей количества вещества является моль. Моль - количество вещества, содержащего 6,02 ×1023 структурных элементов: атомов, молекул, ионов, эквивалентов.
Таким образом, молъ эквививалентов - количество вещества, содержащего 6,02*1023 эквивалентов. Массу одного моля эквивалентов называют молярнои мaccoй эквивалентов вещества (МЭКВ),г/моль.
Например, молярные массы эквивалентов веществ для реакции (а) равны
МЭКВ (Zn) = l/2M(Zn) = l/2 × 65 = 32,5 г/моль;МЭКВ (НСI) = M(HCI) = 36,5 г/моль;
в реакциях (б) и (в) соответственно
МЭКВ (Н2S04) = l/2 М(Н2S04) = l/2 98 = 49 г/моль;
МЭКВ (Н2S04) = М(Н2S04) = 98 г/моль;
в реакциях (г) и (д) соответственно
МЭКВ (Са(OH)2) = М(Са(OH)2) = 74 г/моль;
МЭКВ (Са(OH)2) = l/2 М(Са(OH)2) = l/2 74 = 37 г/моль;
Другими словами , молярная масса эквивалента кислоты (основания) равна отношению молярной массы кислоты (основания) деленной на число атомов водорода замещенных в реакции на металл (соответственно на число гидроксо групп основания, вступивших в реакцию)
Для расчета молярной массы эквивалентов вещества можно использовать формулы:
а) для простого вещества

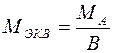 ,
,
где МА - молярная масса атома данного вещества; В – валентность атома элемента;
б) для сложного вещества
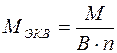 ,
,
где М - молярная масса данного вещества; В - валентность функциональной группы; п - число функциональных групп в молекуле.
Для кислот функциональной группой является ион водорода, для оснований - ион гидроксила, для солей - ион металла.
Например,
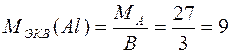 г/моль;
г/моль;

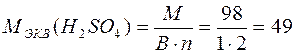 г/моль;
г/моль;

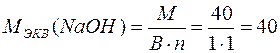 г/моль;
г/моль;
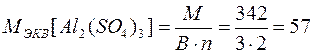 г/моль.
г/моль.
Остановимся на понятии объема моля эквивалентов газа. Как известно, моль любого газа при нормальных условиях (Т = 273 К,
p = 101,3 кПа или 760 мм рт. ст.) занимает объем, равный 22,4 л. Исходя из этой величины можно рассчитать объем одного моля эквивалентов газа при нормальных условиях.
Например, для водорода: Э(Н2) = 1/2Н2; моль эквивалентов водорода в два раза меньше его моля (молекул) и поэтому объем одного моля эквивалентов водорода также в два раза меньше его молярного объема: 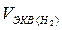 = 22,4 л : 2 = 11,2 л.
= 22,4 л : 2 = 11,2 л.
Для кислорода: Э( 02) = 1/4 О2, отсюда объем одного моля эквивалентов кислорода в четыре раза меньше его молярного объема: 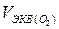 = 22,4 л : 4 = 5,6 л.
= 22,4 л : 4 = 5,6 л.
Все вещества реагируют друг с другом в эквивалентных количествах. Массы (объемы) участвующих в реакции веществ пропорциональны молярным массам (объемам) их эквивалентов(закон эквивалентов). Для реакции А + В = Д закон эквивалентов будет иметь вид:
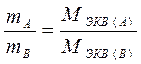
 или
или 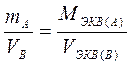 и
и 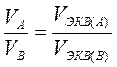
Поделив массу каждого вещества на молярную массу его эквивалента, получаем
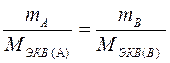 ,
,
т.е. количества молей эквивалентов, участвующих в реакции веществ, равны между собой.
Например, количество молей эквивалентов всех веществ для реакции
2Al(OH) + 3 Н2S04 = Al2(S04)3 + 6H2O равно
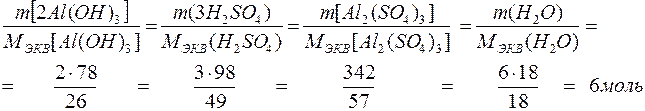
Пример 1.Какую навеску алюминия растворили в кислоте, если объем выделившегося водорода при Т=291K, РН2 = 734 мм рт. ст. равен 113 мл?
Решение. а) Находим объем,который занимают, 113 мл водорода при нормальных условиях

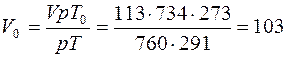 мл.
мл.
б) Зная, что молярная масса эквивалентов алюминия МЭ(Аl) =9 г/моль и объемодного моля эквивалентов водорода при н.у. равен 11,2 л, по закону эквивалентов рассчитываем навеску алюминия:
9 г Аl вытесняют из кислоты 11 200 мл Н2
х г Аl вытесняют из кислоты 103 мл Н2
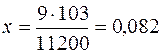 г Al.
г Al.
Следовательно, в кислоте растворили 0,082 г Аl.
Пример2. Молярная масса эквивалентов металла равна 56 г/моль. Сколько мл кислорода (н.у.) образуется при разложении 1,28 г оксида этого металла?
Решение. а) Определяем, молярную массу эквивалентов оксида металла. Оксид металла - это соединение металла с кислородом. Поэтому молярная масса эквивалентов оксида представляет собой сумму:
МЭКВ (оксида) = МЭКВ(металла) + МЭКВ(кислорода) = 56 + 8 = 64г/моль
б) Зная, что 1 моль эквивалентов кислорода при н.у. занимает объем 5,6. л, по закону эквивалентов рассчитываем объем образовавшегося кислорода:
64 г оксида металла образуют 5600 мл 02 ,
1,28 г оксида металла образуют х мл О2
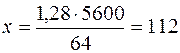 мл.
мл.
Оборудование и реактивы: штативы для бюреток, две бюретки на 20 мл, соединительные трубки, пробирка, кристаллизатор, мерный цилиндр, колба круглодонная, навеска металла, навеска Na2CO3, раствор HCl, вода.
ЭКСПЕРИМЕНАЛЬНАЯ ЧАСТЬ
Опыт 1. Определение молярной массы эквивалентов металла (Mg, Al или Zn) методом вытеснения водорода
Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее металла.
Применяемый для этой цели прибор (рис. 1) состоит из двух бюреток 2 и 3, укрепленных на штативе 1 и соединенных резиновой трубкой 4. В такой сообщающийся сосуд наливают воду приблизительно до половины бюреток. Бюретку 3 сверху закрывают пробкой с отводной трубкой, к которой присоединяют пробирку 5 с концентрированной соляной кислотой, где происходит реакция между кислотой и металлом. Бюретка 2 служит приемником для воды, вытесняемой выделяющимся при реакции водородом.
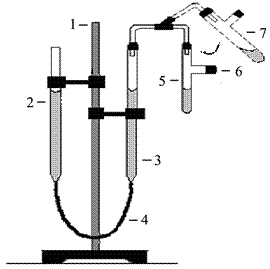
Рисунок 1 – Прибор для определения эквивалента металла объемным методом:
1 – штатив; 2, 3 – бюретки с водой; 4 – соединительная трубка; 5 – рабочая пробирка; 6, 7 – положения рабочей пробирки (5).
Объем выделившегося водорода определяют по разности, уровней воды в любой из бюреток до и после опыта при давлении в закрытой бюретке 3, равном атмосферному. Давление газа в закрытой бюретке 3 равно атмосферному, если вода в обеих бюретках находится на одном уровне.
Даже при комнатной температуре пар над поверхностью воды обладает заметным давлением. Поэтому для определения парциального давления водорода необходимо от общего (атмосферного) давления, под которым находится водород, вычесть давление насыщенного водяного пара h (см. таблицу 1):
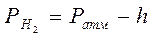
Таблица 1
Давление насыщенного водяного пара при различных температурах
| t, 0C | Па | мм рт.ст. | T, 0C | Па | мм рт.ст.  |
| 1705,1 | 12,79 | 2643,7 | 19,83 | ||
| 1817,1 | 13,63 | 2809,0 | 21,07 | ||
| 1947,1 | 14,53 | 2983,7 | 22,38 | ||
| 2063,8 | 15,48 | 3167,2 | 23,76 | ||
| 2197,1 | 16,48 | 3361,0 | 25,21 | ||
| 2337,8 | 17,53 | 3564,9 | 26,74 | ||
| 2486,4 | 18,65 | 3779,6 | 28,35 |
Для приведения объема выделившегося водорода к нормальным условиям используют уравнение, газового состояния
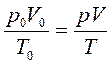
где V0 - объем выделившегося водорода при н.у., мл; Р0 - парциальное давление водорода при н.у., равное 101,3 кПа (760 мм рт. ст.); Т0 - температура, 273 К; V - объем выделившегося водорода при условиях опыта, мл; р - парциальное давление водорода при данных условиях, кПа (мм рт. ст.); Т - температура опыта, К.
Определив объем водорода при н.у., вычисляют массу 1 моль эквивалентов металла:
т г металла вытесняют Vo мл водорода
х г металла вытесняют 11200 мл водорода
Получить навеску металла у лаборанта. Перед началом опыта бюретки должны находиться в таком положении относительно друг друга, чтобы уровень воды в них был примерно на середине шкалы отсчета. В пробирку 5 налить соляной кислоты (наодну четверть пробирки). Отводную трубку (6) и закрывающую ее пробку перед началом опыта насухо протереть фильтровальной бумагой, после чего в нее поместить полученный образец металла с известной массой m. Трубку плотно закрыть пробкой, осторожно ввинчивая ее.
Затем необходимо проверить герметичность прибора. Для этого, не трогая бюретку 3 с пробиркой 5, переместить бюретку 2 вместе с лапкой штатива так, чтобы уровень воды в ней стал на 5-10 см выше, чем в бюретке 3. Если прибор не герметичен, то уровни в обеих бюретках будут выравниваться. В этом случае нужно проверить положение всех пробок и снова проверить прибор.
Привести воду в бюретках к одному уровню и отметьте уровень воды в открытой бюретке 2. Отсчет произвести по нижнему мениску жидкости с точностью до 0,1 мл.
Стряхнуть осторожно металл в кислоту, переводя пробирку 5 из положения 6 в положение 7. Наблюдать выделение водорода и вытеснение воды из бюретки 3.
По окончании реакции дать пробирке охладиться на воздухе, после чего снова, привести воду в бюретках к одинаковому уровню. Записать новый уровень воды в бюретке 2. По разности уровней воды до и после реакции рассчитать объем выделившегося водорода.
По данным опыта определить молярную мaccy эквивалента металла. Сравнивая ее с теоретическим значением молярной массы эквивалентов металла (Mg, Al, Zn), определить, какой металл был взят для реакции.
Записать в журнал: массу навески металла, г; уровень воды в бюретке 2 до реакции, мл; уровень воды в бюретке 2 после реакции, мл; температуру, К; атмосферное давление, кПа (мм рт. ст.); давление насыщенного водяного пара, кПа (мм рт. ст.);давление водорода, кПа (мм рт. ст.).
По полученным данным рассчитать:
1) объем выделившегося водорода;
2) объем - водорода при нормальных условиях;
3) теоретическую молярную массу эквивалентов Mg, Al, Zn;
4) опытную молярную массу эквивалентов металла;
5) ошибки опыта: а) абсолютную; б) относительную.
Записать уравнение реакции взаимодействия металла с соляной кислотой.
Опыт 2. Определение эквивалента карбоната натрия
Для определения эквивалента карбоната натрия проводят реакцию: Na2CO3 +2HCl = 2NaCl + CO2↑ + H2O.
Порядок выполнения опыта: Наполнить кристаллизатор 1 (рис. 2) на половину его объема насыщенным раствором поваренной соли, в котором растворимость диоксида углерода меньше, чем в воде. Тем же раствором наполнить вровень с краями мерный цилиндр 2 вместимостью 100 мл и закрыть его стеклянной пластинкой, надвигая последнюю скользящим движением.
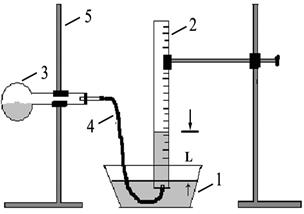
Рисунок 2 – Прибор для определения молярной массы эквивалента карбоната натрия:
1 – кристаллизатор; 2– мерный цилиндр; 3 – колба круглодонная; 4 – газоотводная трубка; 5 – штатив
Перевернуть цилиндр вверх дном и опустить в кристаллизатор. Удалить под раствором стеклянную пластинку и закрепить цилиндр в лапке штатива так, чтобы края цилиндра были ниже уровня раствора в кристаллизаторе, следя за тем, чтобы в цилиндр не попал воздух. В колбочку вместимостью 50 мл налить 8-10 мл 2 н. раствора хлороводородной (соляной) кислоты, вытереть горло колбы фильтровальной бумагой и закрепить ее в штативе в горизонтальном положении. Навеску соли (~ 0,3-0,4 г) карбоната натрия поместить осторожно в горло колбы таким образом, чтобы кристаллы не могли преждевременно упасть в кислоту, плотно закрыть колбу пробкой с газоотводной трубкой и подвести открытый изогнутый конец трубки под цилиндр.
Вынуть колбу из штатива и медленно, чтобы не происходило очень бурного выделения диоксида углерода, пересыпать карбонат натрия небольшими порциями в кислоту аккуратными наклонами колбы. В конце опыта стряхнуть остатки кристаллов в колбу. По окончании выделения газа вновь закрепить колбу в штативе. Измерить в цилиндре объем выделившегося диоксида углерода и с помощью миллиметровой линейки измерить расстояние l от уровня воды в кристаллизаторе до уровня воды в цилиндре.
Записать в журнал: массу карбоната натрия, m, г; объем выделившегося диоксида углерода, V, мл; расстояние от уровня воды в кристаллизаторе до уровня воды в цилиндре, l, мм; температуру опыта, 0С; атмосферное давление, p.
По уравнению Менделеева – Клапейрона:
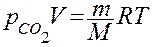
вычислить массу m диоксида углерода. Для определения давления 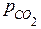 следует из атмосферного давления p вычесть давление столба жидкости
следует из атмосферного давления p вычесть давление столба жидкости 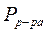 . Таким образом
. Таким образом 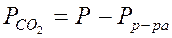 , где
, где
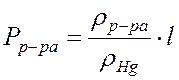
Плотность насыщенного раствора хлорида натрия rр-ра = 1,20 г/см3, плотность ртути 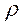 Hg = 13,60 г/ см3. Парциальным давлением водяного пара ввиду его малого значения в насыщенном растворе поваренной соли в данном опыте можно пренебречь.
Hg = 13,60 г/ см3. Парциальным давлением водяного пара ввиду его малого значения в насыщенном растворе поваренной соли в данном опыте можно пренебречь.
В реакции нейтрализации, протекающей с образованием NaCl, эквивалент Э(CO2) = ½ (CO2), поэтому молярная масса его эквивалента равна МЭКВ (CO2 ) = ½M(CO2). Применяя закон эквивалентов
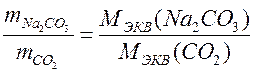 ,
,
вычислить экспериментальное значение молярной массы эквивалента Na2CO3. Найти абсолютную и относительную погрешность измерения.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
1. Сколько оксида получится при окислении 3 г металла, молярная масса эквивалента которого равна 9 г? (Ответ: 5,7 г)
2. Определить молярные массы эквивалентов, количества молей эквивалентов кислот и оснований в следующих реакциях:
а) HNO3 + Bi(OH)3 = Bi(OH)2NO3 + H2O
б) H2S + NaOH = NaHS + H2O
в) 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
г) H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
д) 2HCl + Bi(OH)3 = BiOHCl2 + 2H2O
е) 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
3. Какие объемы занимают при нормальных условиях массы одного эквивалента кислорода и одного эквивалента водорода?
(Ответ: 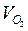 = 5,6 л;
= 5,6 л; 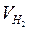 =11,2 л)
=11,2 л)
4. Определить молярную массу эквивалента металла, если 0,046 г его вытеснили из кислоты 62,35 мл водорода, собранного над водой при температуре 17 0С и давлении 1,017 ∙105 Па. Давление водяного пара при 17 0С равно 0,193 ∙105 Па. (Ответ: 88,9 г)
5. Вычислите эквивалент и молярную массу эквивалента H3PO4 в реакциях образования: a) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
6. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалента, мольную массу и атомную массу металла.
7. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти молярную массу эквивалента железа, если известно, что молярная масса эквивалента серы равна 16 г/ моль. (Ответ: 28 г/моль)
8. Некоторое количество металла, молярная масса эквивалента которого равна 28 г/моль, вытесняет из кислоты 0,7 г водорода, измеренного при нормальных условиях. Определить массу металла.
(Ответ: 1,76 г)
9. Определить молярные массы эквивалентов элементов в соединениях HBr, H2O и NH3.
10. При сгорании трехвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите молярную массу эквивалента оксида.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н.В. Общая химия. – М.: Высш. шк. 2000. – 557 с.
2. Хомченко Г.П., Цитович И.К. Неорганическая химия. – М.: Высш. шк. 1987. – 463 с.
3. Коровин Н.В., Мигулина Э.И., Рыжова Н.Г. Лабораторные работы по химии. – М.: Высш.шк. 2001. – 256 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Интеграл-Пресс. 2001. – 239 с.
5. Глинка Н. Л. Общая химия: Учебное пособие для вузов / Под ред. А. И. Ермакова. – Изд. 29-е, исправленное – М.: Интеграл-Пресс. 2001. –728 с.
6. Практикум по общей химии /Под ред. Е.М. Соколовской, О.С. Зайцева. 3 – е изд. – М.: Из –во Моск. ун-та. 1981. – 400 с.
7. Зубрев Н.И. Инженерная химия на железнодорожном транспорте. – М.: УМК МПС РФ. 1999. – 291 с.
СОДЕРЖАНИЕ
Лабораторная работа 1. Химические свойства металлов 3
Лабораторная работа 2. Коррозия металлов и защита от коррозии 17
Лабораторная работа 3. Эквивалент и молярная масса эквивалента 28
Рубчевская Людмила Александровна
