Теория селективности мембранных электродов
Мембранный электрод характеризуется областью активности (концентрации) соответствующего иона, для которой выполняется электродная функция. Потенциал мембранного электрода может быть найден как относительная величина из э.д.с. сложной электрохимической цепи. В общем случае мембранный потенциал может быть представлен как разность потенциалов между растворами 1 и 2, включая диффузионный потенциал внутри мембраны и фазовые потенциалы. При этом мембрана предполагается проницаемой для ионов только одного знака заряда, т.е. обладает либо катионной, либо анионной функцией:
Электрод сравнения | Раствор 1 | Мембрана | Раствор 2 | Электрод сравнения (а)
Конкретная цепь для растворов хлоридов однозарядных металлов, разделенных мембраной с катионной функцией, имеет вид:
j’AgCl Раствор 1 j’ j’’ Раствор 2 j’’AgCl
Ag | AgCl, ACl (m’) | Мембрана катионитовая | ACl (m’’), AgCl | Ag (б)
Мембранный электрод
Потенциал на границе раздела мембрана - раствор 2 является функцией составов раствора 2 и мембраны:
j = j02 + Jlg (a’’A/aA). (1)
где j02 - стандартный потенциал; a’’A и aA - активность иона А+ в водном растворе 2 и мембране. Если aA = const, то и Jlg (a’’A/aA) = const, следовательно в стандартных условиях когда a’’A = 1, j0 = j02 - JlgaA = j02 - const. Поэтому можно записать:
j = j0 + Jlga’’A. (2)
ЭДС элемента может быть записана как алгебраическая сумма потенциалов:
Е= j’AgCl - j’ + j’’ - j’’AgCl
Суммируя потенциалы в элементе (б), получим выражение для э.д.с.:
E = Jlg (a’’ACl/a’ACl); (3)
при a’ACl = const,
E = E0 + JlgaА’’. (4 )
С помощью уравнения (4 ) оценивается интервал выполнения электродной функции иона А+.
Более общий и практически более важный случай, когда растворы 1 и 2 содержат два или несколько сортов ионов, можно представить в виде элемента
Ag | AgCl, ACl(m’), BC1(m’)| Мембрана | ACl(m’’), BC1(m’’) AgCl | Ag (в)
j’AgCl Раствор 1 j’ j’’ Раствор 2 j’’AgCl
Если принять, что потенциал мембраны (стекла) по отношению к раствору возникает в результате установления равновесия следующего ионообменного процесса, протекающего между раствором и мембраной:
A+M + B+ « B+M + A+; (5 )
KB-A = aBMaA/aAMaB, (6)
где A+M и B+M - катионы в фазе мембраны; KB-A - константа равновесия реакции (5 ).
Разность потенциалов на границе мембрана-раствор 2 описывается уравнением
j = j0 + Jlg(aA + KB-A aB). (7 )
Для э.д.с. элемента (в)
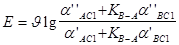 . (8 )
. (8 )
При a’ACl = const и a’BCl = const,
Уравнения (7) и (8) определяют через величину KB-A степень влияния ионов B+ на определение ионов A+- функцию мембранного электрода, т.е. KB-A можно считать количественной мерой специфичности.
Селективность мембранных электродов и методы ее оценки. Основное назначение ионоселективных электродов - определение содержания ионных компонентов в сложных по составу растворах. Факторами, определяющими селективность различных мембран, являются коэффициенты равновесия (обмена, распределения, комплексообразования) и подвижности различных заряженных частиц в мембране.
Для количественной оценки константы (коэффициента) селективности для ионов любого знака заряда принято использовать полуэмпирическое уравнение для э.д.с. элемента типа (а):
E = E’ +J/ZAlg(aA + SKA/B( aB) zB/zA),
где KA/B - коэффициент специфичности электрода по отношению к определяемому иону А+ на фоне мешающих ионов В+. Экспериментально определяемая величина KA/B зависит от состава раствора и концентрации ионообменника в мембране, поэтому называется коэффициентом селективности. Хорошие ионоселективные электроды обладают коэффициентом селективности 10-3-10-5.
