Дія цинкуранілацетату (Zn(UO2)3(Ac)8 або ZnAc2∙3UO2Ac2, де Ac− − іони CH3COO− ).
Реагент є специфічним для іонів натрію. В нейтральних або оцтовокислих розчинах він утворює з солями натрію кристалічний осад зеленкувато-жовтого кольору. Ця реакція виконується краплинним способом. Рівняння реакції можна записати так:
Na+ + Zn(UO2)3Ac8 + HAc = NaZn(UO2)3Ac9 + H+.
Виявленню іонів натрію цією реакцією не заважають іони K+, NH4+, Mg2+, Ba2+, Sr2+, Ca2+ (у 20-кратному надлишку), а також деякі катіони третьої – п’ятої груп. Заважають іони Hg22+, Sb3+, PO43−, AsO33−, AsO43−, які утворюють з реактивом білі осади. При додаванні реагенту до розчину Fe3+ утворюється ацетатний комплекс заліза, тому розчин набуває червоного кольору, але осад не випадає, і тому Fe3+ практично не заважає виявленню натрію.
Якщо при дії реагенту на досліджуваний розчин випадають білі голчасті кристали (це може статися при високій концентрації іонів K+), до одержаного осаду додають декілька краплин дистильованої води; цей осад розчиняється, а осад NaZn(UO2)3Ac9 залишається.
Забарвлення полум’я.
З катіонів першої групи лише сполуки калію та натрію забарвлюють полум’я в характерні кольори. Дослід виконують таким чином: вушко платинової дротинки, впаяної в скляну паличку, змочують концентрованою соляною кислотою і прожарюють у безбарвному полум’ї газового пальника. Операцію обробки дротинки соляною кислотою повторюють, поки полум’я пальника не стане безбарвним. Очищену дротинку вміщують у досліджуваний розчин (або суху досліджувану речовину), а потім у полум’я. За наявності натрію полум’я забарвлюється в жовтий колір, а за наявності калію – в блідо-фіолетовий. Дослід буде успішним, коли провести попереднє концентрування K+ на платиновій дротинці, застосувавши багаторазове змочування її досліджуваним розчином з наступним обережним висушуванням.
Якщо у розчині є обидва катіони, іон натрію заважає виявленню калію, тому що забарвлення його полум’я більш яскраве і воно забиває забарвлення солі калію.
Екзаменаційний білет 2
Помилки при проведенні хімічного аналізу . математична обробка результатів аналізу.
При проведенні хімічного аналізу допускається помилка яка відображається на результатах аналізу
За характером помилки бувають
Випадкові і систематичні . Промахи- грубі помилки.
Випадкові помилки не можуть бути усуненні, але їх вплив може бути врахований статистичною оцінкою результатів аналізу. Випадкові помилки можуть бути зв’язані з недотриманням операцій, чистоти реактивів. . Систематичні помилки пов’язані з недосконалістю приладів , з неправильним вибором методики. Систематична помилка обумовлена причинами відомої природи або ж причинами, які можуть бути виявленні при детальному розгляді методики. Їм відповідає поняття «правильність методу аналізу»
Види систематичних помилок
1.Методичні (усуванні і не усуванні )
2. Оперативні
3. Індивідуальні
При статистичній обробці аналізу слід розрізняти помилки, похибки результату аналізу.
Серед похибок розрізняють абсолютні та відносні похибки.
 ⌂m= mіст-mрозрах.
⌂m= mіст-mрозрах.
⌂х=хіст- хроз.
Е= (mіст- mроз/ mіст )* 100%
E=(⌂/ mіст)*100%
Dсер= 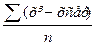
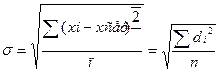
Достатньо для характеристики відтворювальності результатів, чим менше dсер тим більш точніше визначення викривлення похибки. Більш точніше є стандартне відхилення 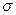 , що є кількісною мірою відтворювальності результатів
, що є кількісною мірою відтворювальності результатів
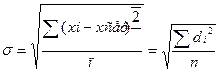
Якщо при 100 визначень 3 тільки вийдуть за межі виборки. Тоді буде розраховуватись дисперсія, або середнє квадратичне відхилення.
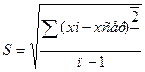
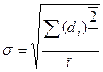
Джерела похибок хімічного аналізу. При виконанні будь якого аналізу звичайно проводять ряд аналітичних операцій ( наприклад зважування , розчинення, осаджування, фільтрування, осушування, титрування, фотометрування.) Всі ці аналітичні операції і вимірювання можуть супроводжуватися похибками. Наприклад промивання осаду може призвести до часткової втрати його внаслідок розчинності гігроскопічної речовині речовини при зважуванні поглинає вологу з повітря , що веде до збільшення їх маси, поспішність у кінці титрування неминуче веде до пере титрування.. Неточне вимірювання шкали приладу ( наприклад бюретки) відкликає до похибки вимірювання.
2. Друга аналітична група катіонів. Дія групового реагенту . Реакції виявлення та відкриття катіонів Ag+, Pb2+, Hg2+.
Катіони другої аналітичної групи утворені хімічними елементами різних груп періодичної таблиці : першої ( Ag ), другої ( Hg ) груп побічних підгруп те четвертої групи головної підгрупи ( Pb ).
Оскільки в атомі Ag є d - , а в атомі Hg є d - і f – стиснення, то атоми мають близькі, невеликі радіуси і великі енергетичні характеристики, слабкі відновники. Вони утворюють катіони з такими електронними формулами:
47 Ag + ... 4s24p64d10 80 Нg22+ ... 5s25p65d106 s1
Для них характерна:
Стехіометрична валентність І (Ag +) і ІІ (Нg22+ )
Ступінь окиснення + 1 (Ag+ , Нg22+ )
Заряд йонів 1+ (Ag+) або (Нg22+)
Оксиди :
Ag2О – темно – коричневий
Ag+ + ОН - = AgОН↓
2 AgОН → Ag2О + Н2О
Нg2О – чорного кольору у вільному стані не виділений
Нg2О = Нg↓ + НgО
Гідроксиди :
Нg2( ОН )2 = Нg2О+ Н2О
Дія групового реагенту
Ag+ + СІ- = AgСІ↓ аморфний сірнистий осад білого кольору
Нg22+ + 2СІ- = Нg2СІ2↓ порошкоподібний білий осад
Pb2+ + 2СІ- = PbСІ2 ↓ білий кристалічний осад
Умови : розведена хлоридна кислота, стехіометрична кількість речовини НСІ, понижена температура.
Реакції Ag+ - катіона
З солей Ag+ - катіона добре розчиняються у воді:
AgNO3, AgF, AgCIO3 , AgCIO4 , AgMnO4
Малорозчинні : AgCH3COO Ag2SO4 AgNO2
Характерні реакції Ag+
1. Хлоридна кислота НСІ та її солі осаджують з нейтральних розчинів
Ag+ - катіон
AgNO3 + НСІ = AgСІ↓ + НNO3
Ag+ + СІ- = АgСl
2. NaOH, або КОН з Ag утв. чорний осад Ag2О
АgСl + NaOH= Ag2О + H2O + NaCl
Ag+ +OH -→ Ag2О + H2O
3. NH3·H2O з Ag утв. чорний осад Ag2О
Ag+ + 2 NH3·H2O → Ag2О + 2 NH4+ + H2O
4. КІ - з Ag утв. жовтй осад AgІ
Ag+ + І-→ AgІ
Осад AgІ розчиняється лише у присутності великого надлишку КІ.
5. К2Cr2O7 з Ag утв. цегляно-червоний осад Ag2 CrO4
2Ag++ CrO42-→ Ag2 CrO4
Осад Ag2 CrO4 розчиняється в нітратній кислоті в амоніаку і не розчиняється ацетатній кислоті . Реакції заважають йони плюмбуму , барію, стронцію, меркурію, кобальту.
5. Н2Dz з Ag утв. осад фіолетового кольору Ag НDz
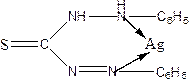
6.Н2SO4 з Ag утв. осад білого кольору Ag2SO4
2.Ag++ SO42-→ Ag2 CrO4
Умови реакції досить велика концентрація Ag+ і SO42 йонів.
7. НСООН – формальдегід відновлює Ag+ до вільного срібла.
Умови реакції
- Амоніачно-лужна реакція розчину
- нагрівання
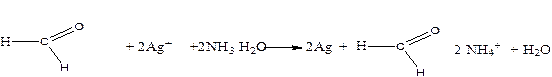
8. Na2S2O3 з Ag утв. осад білого кольору Ag2S2O3
2.Ag+ + S2O32- → Ag2S2O3
Осад розчиняється в надлишку реактиву завдяки проходженню процесу комплексоутворення
Ag2S2O3 + S2O32- → 2[Ag (S2O3)2]3-
Осад легко розчиняється у надлишку амоніаку .
AgСІ + 2NH3 = [Ag( NH3)2]CI
При дії НNO3 випадає б ілий осад
[Ag( NH3)2]CI + 2 НNO3 = AgСІ↓ + 2 NH4NО3
[Ag( NH3)2]+ + СІ- + 2Н+= AgСІ↓ + 2 NH4 +
Реакція фармакопейна.
Реакції Нg22+ - катіона
Більшість сполук дімеркурій І – катіона малолорозчинні у воді.
Не розчинні : Hg2CI2 ,Hg2I2
Малорозчинні: Hg2SO4, Hg2CrO4
Розчинні: Hg2(NO3)2 , Hg2( CIO3)2 , Hg2( CIO4)2
Характерні реакції Нg22+
1. NaOH або KOH з Нg22+ - йоном утворює чорний осад
Нg22+ + 2ОН- = Нg2О↓ + Н2О
2.КІ – йодид калію з Нg22+ - йоном утворює зелений осад
Нg22+ + 2І- = Нg2І2↓
При надлишку калію йодиду
Нg2І2 + 2І-= [НgІ4] + Нg
3. .NH3·H2O з Нg22+ утв. Білий осад димеркурій амід моно оксид нітрату і чорний осад вільної ртуті.
Нg22+ + 2 NH3·H2O + NO2-→ [Нg2ONH2]NO3 +2 Нg + 2 NH4+ + H2O
4. К2Cr2O4 з Нg2+2 утв. На холоді бурий аморфний осад Нg2 CrO4, який при кипятіні переходить у червоний кристалічний осад.
Нg2+2 + CrO42-→ Нg2 CrO4
Осад не розчиняється в лугах і нітратній кислоті
5.Купрум відновлює Нg2+2 до вільної ртуті
Нg2+2 + Сu → Сu2++ 2 Нg
Умови досліду : мідна пластинка обезжирена і очищена наждачним папером , відсутність сильних окисників.
6. Дифенілкарбазон і дифенілкарбазит з Нg2+2 дають сполуку блакитного кольору або синьо фіолетового.
Дифеніл карбазон і Дифенілкарбазит
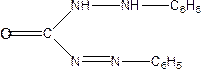
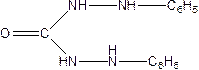
Утв з Нg2+2 сполуку
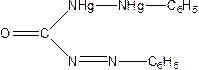 димеркурій(І) дифеніл карбазонат.
димеркурій(І) дифеніл карбазонат.
Умови реакції: відсутність Нg(ІІ) – катіона і CrO4—аніона в кислому розчинні.
Відсутність Сr(III), Fe(II), Fe(III), Co(II) i Cu(II) катіонів у нейтральному і ацетатнокислому розчинах.
7. Н2SO4 з Нg22+ утв. осад білого кольору Нg2SO4, який розчиняється у в концентрованій нітратній кислоті.
Нg22+ + SO42-→ Нg2SO4
8. Na2CO3 або K2CO3 з Нg22+ утв. Жовтуватий осад, нестійкий тому поступово сіріє внаслідок дисмутації.
Нg22+ + СО32- -→ Нg2СO3
Нg2СO3→ НgO + Нg + СO2
Характерні реакції на плюмбум(ІІ) катіон
1. NaOH або KOH з Рb2+ - йоном утворює білий осад Pb(OH)2
Рb2+ + 2ОН- = Pb(OH)2
Pb(OH)2 амфотерний розчиняється в NaOH або KOH , HNO3.
Pb(OH)2 + 2OH-→ [Pb(OH)4]2-
Pb(OH)2+ CH3COOH→ Pb(CH3COO)2 + H2O
2.КІ – йодид калію з Рb2+ - йоном утворює жовтий осад
Рb2+ + 2І- = РbІ2↓
РbІ2 + СН3СООН→ Pb(CH3COO)І
Умови :Стехіометрична кількість речовини реактиву КІ
3.NH3·H2O з Рb2+ утв. Плюмбум гідроксид який не розчиняється в надлишку реактиву.
Рb2+ + 2 NH3·H2O→ Pb(OH)2+ 2 NH4+
4. К2Cr2O4 і К2Cr2O7 з Рb2+ утв. жовтий дрібнокристалічний осад плюмбуму
2Рb2+ + CrO42-→ РbCrO4
2Рb2+ + Cr2O72-+ 2 СН3СОО- +НОН→2РbCrO4 + 2СН3СООН
РbCrO4 – розчиняється в лугах і практично не розчиняється в аміаку, в амоній ацетаті.
5. Н2SO4 з Рb2 + утв. білий кристалічний осад РbSO4,
Рb2 + + SO42-→ РbSO4,
6. Na2CO3 або K2CO3 з Рb2+ утв. Рb2+ осад білого кольору.
Рb2++ CO32- → РbCO3
7. КSCN з Рb2+ утв білий осад.
Рb2 + + 2 SCN-→ Рb(SCN)2
- Вплив однойменних та сторонніх йонів на розчинність електролітів. Сольовий ефект.
Сольовий ефект це підвищення розчинності малорозчинних електролітів, які перебувають у рівновазі з осадом, при додаванні до них сильних електролітів, що не містять однойменних йонів з осадом.
Наприклад, експериментально встановлено, що розчинність сульфатів СаS04, SrS04 і ВаS04 збільшується при додаванні до їх насичених розчинів, які перебувають у рівновазі з осадом, розчинів КС1, NаСІ, KNO3, розчинність цих сульфатів тим більша, чим більша концентрація речовини добавленої солі у розчині.
Сольовий ефект пояснюється на основі вчення про активність йонів і йонну силу розчину. При доливанні до насиченого розчину малорозчинного електроліту іншого, сильного електроліту, який не має спільних йонів з малорозчинним електролітом, йонна сила розчину зростає, а коефіцієнти активності йонів зменшуються. Це веде до того, що величина добутку розчинності малорозчинного електроліту стає більшою, ніж величина добутку розчинності цього електроліту в чистій воді.
За теорією сильних електролітів сольовий ефект обумовлений зменшенням коефіцієнтів активності йонів внаслідок підвищення йонної сили розчину при додаванні сторонніх електролітів.
Різні електроліти, прилиті в однаковій кількості, дають різний сольовий ефект, оскільки йони мають різну величину зарядів, що впливає на величину йонної сили.
Осадження можна вважати практично повним, якщо в розчині залишається така кількість речовини осаджуваних йонів, яка не заважає в подальших операціях розділення і виявлення йонів. Оскільки константа ДР ніколи не буває рівною нулю, то осадження гіе може, бути абсолютно повним. Частина осаджуваних йонів завжди залишається у розчині. Для більш повного осадження до розчину додають деякий надлишок реагенту - осаджувача.
Повнота осадження йона залежить від розчинності сполуки, у вигляді якої осаджується цей йон. Практично при осадженні будь-якого йона'даю ть півторакратний надлишок осаджувача у порівнянні зіьстехіометричним, коли осадження буде повним. Проте дужо великий надлишок осаджувача веде до розчинення осаду.(сольовий ефект).
Вплив однойменних йонів. Якщо до насиченого розчину малорозчинного електроліту долити розчин іншого електроліту, який містить однойменний йон з осадом, то добуток молярноїконцентрації йонів стане більшим за величину добутку розчинності, розчин стає пересиченим, а пересичені розчини нестійкі; при стоянні вони виділяють частину розчиненої речовини у вигляді осаду. Розчинність малорозчинного електроліту понижується в найбільшій мірі при введенні в розчин того йона, стехіометричний коефіцієнт якого у формулі вищий.
4. Розрахувати масовий вміст Mg(ω , %) у сплаві з алюмінієм, виходячи з наступних даних: маса наважки сплаву – 1,0135г, гравіметрична форма – Mg2P2O7, її маса – 0,1325г.
Дано
 mн=1,0135г mгравіметричної форми=0,1325 Mg2P2O7 mн=1,0135г mгравіметричної форми=0,1325 Mg2P2O7 |
W-?
Яка масова частка Mg у сплаві-?
W(%)(Mg)= 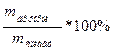
W(%)(Mg)= 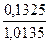 * 100%=13%
* 100%=13%
Відповідь: Масова частка магнію становить 13%.
Білет №3
Питання 1
Гравіметричний (вагов.) метод аналізу – це метод кількісного хім. аналізу, який ґрунтується на точному вимірюванні маси речовини, що визначається або її складових частин, що виділяються у чистому стані або у вигляді відповідних сполук.
Основні операції: попередня підготовка скляного посуду; розрахунок наважки; взяття наважки; розчинення аналізуючої речовини; осадження; фільтрування; промивання осаду; висушування; прокалювання і зважування; розрахунок результатів. Осад, що утворюється при гравіметричному аналізі повинен бути практично нерозчинним, відокремлюватися від фільтрату.
Розрізняють три варіанти ваговаго аналізу:
1) визначення вологи – наважку р-ни висушують, волога випаровується, маса зменшується.
W(вологи)= 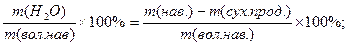
2) визначення золи – спалюють точну наважку р-ни, прокалюють залишок до тих пір поки маса перестане зменшуватися:
W(золи)= 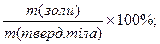
3) по масі осаду – речовину переводять в осад, який фільтрують,промивають, висушують, зважують і по масі визначають вміст аналізуючої речовини.
W(Ва)= 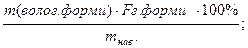
W(Fe)= 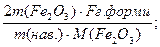
F – аналітичний фактор = 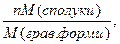 показує масу в грамах визначуваного елемента в 1г осаду. F = 0,6994.
показує масу в грамах визначуваного елемента в 1г осаду. F = 0,6994.
Питання 2
Катіони 3-ої анал. гр утворюють хім. елементи 2 гр. головної підгрупи період. системи, тобто лужноземельні метали.
1) Дія групового реактиву Н2SO4:
Ме2+ + SO42- = МеSO4¯, утв-ся осади сульфатів – білі.
2) Na2CO3 – з катіонами 3-ої аналіт.гр. утворює білі аморфні осади.
Ме2+ + СО32- ® МеСО3¯. Перевіряють розчинність одержаних карбонатів y HCl, HNO3, CH3COOH. Карбонати Са2+ - Ва2+ легко розчиняються у НСl, HNO3, CH3COOH, і H2CO3 у останньому випадку утворюються гідроген солі: CaCO3 + CO2 + H2O®Ca(HCO3)2.
3) (NH4)2CO3 – амоній карбонат з Ca2+, Sr2+, Ba2+ утворює білі аморфні осади: МеCl2+(NH4)2CO3®MeCO3¯+NH4Cl.
ДР(CaCO3)=1,7×10-8, SrCO3=9,4×10-10, BaCO3=4,9×10-9. Тому при кипятінні сульфатів CaSO4, BaSO4, SrSO4 з р-ном Na2CO3 відбувається перехід сульфатів в карбонати. MeSO4+CO32-® MeCO3¯+SO. BaCO3 розчиняють у CH3COOH і відкривають Ва2+характерними реакціями:
BaCO3+2CH3COOH® Ва2+2CH3COO-+Н2О+СО2.
4) (NH4)2C2O4 – диамоній оксалат з Са2+ і Ва2+-іонами утворює білі дрібнокристалічні осади оксалатів.:
Ме2++С2О42-®MeC2O4¯. Розчинність оксалатів у CH3COOH різна: СаС2О4 не розчин. в CH3COOH, SrС2О4 дещо розчиняється, ВаС2О4 розчиняється в гар. CH3COOH.
5) Nа2НРО4 з Ca2+, Ва2+, Sr2+ утворює білі аморфні осади СаНРО4, SrНРО4, ВаНРО4.
Ме2+ + НРО42-®МеНРО4¯;
У присутності амоніаку утворюються середні солі: Са3(РО4)2, Sr3(РО4)2, Ва3(РО4)2.
3Ме2++2НРО42-+ NH3×Н2О®Ме3(РО4)2¯+ NH4+ + 2Н2О.
6) NаОН з Ca2+, Ва2+, Sr2+ утворює білі осади, розчинність яких у ряді Са(ОН)2, Sr(ОН)2, Ва(ОН)2 зростає.
Ме2+ + 2ОН-®Ме(ОН)2¯.
6) (NH4)ОН не утворює з цими катіонами осади.
Характерні та специфічні реакції для катіонів:
Са2+:
1) Nа2С6О6 – динатрій родизонат: фіолетове забарвлення у присут NаОН
CaCl2 + NаОН+ Nа2С6О6®Ca(OH)2×CaC6O6 + NaCl.
2) K4[Fe(CN)6] - калій гексаціаноферат 2, утв-ся кристалічний осад білого кольору, склад якого залежить від умов:
Ca2+ + К+ + NH3×Н2О + [Fe(CN)6]4-®СаNН4K[Fe(CN)6]¯ + ОН-;
Ca2+2 NH4+ + [Fe(CN)6]4-®(NН4)2Са[Fe(CN)6]¯;
Ca2+ + 2К+ +[Fe(CN)6]4-®К2Са[Fe(CN)6]¯;
2Са2+ + [Fe(CN)6]4-® Са2Fe(CN)6]¯;
3) ВаF2 – утворює білий кристал осад СаF2:
Ca2+ + ВаF2® СаF2+Ва2+.
4) К2CrO4- жовтий осад СаCrO4¯:
Са2+ + CrO42- + 2Н2О® СаCrO4×2Н2О¯;
5) мікрокристалоскопічна р-ція СаSO4×2Н2О виявляють в присутності Н2SO4;
6) р-ція на полум’я – цегляно-червоне.
Sr2+:
1) Nа2С6О6 – утвор. Бурувато-червоний осад:
Sr2+ + С6О62-® SrС6О6¯
2) р-ція з гіпсовою водою: (СаSO4×2Н2О)
Sr2+ + СаSO4® SrSO4¯+ Са2+, утв-ся білий кристал.осад.
3) К2CrO4- утв-ся жовтий кристал осад:
Sr2+ + CrO42-® SrCrO4¯;
4) р-ція на полум’я – кармінно-червон.
Ва2+:
1) Nа2С6О6:
Ва2+ + С6О62-®ВаС6О6¯;
У присутності Н+катіона переходить у гідроген-сіль:
ВаС6О6 + 2Н+ + С6О62-®Ва(НС6О6)- червоно-бурого кольору
2) К2Cr2О7- з Ва2+- катіоном утворює жовтий осад барій хромату(6):
2Ва2+ + Cr2О72-+ НОН®2ВаCrО4¯+2Н+
Або
Cr2О72-+ НОН« CrО42- + 2Н+;
2Ва2+ + 2 CrО42-®2ВаCrО4¯.
У водному розчині Cr2О72- - іон гідролізує зутворенням CrО42- - іона, який зв’язується Ва2+- катіоном у осад. Велина ДР(ВаCrО4) швидше досягається, ніж ДР (ВаCr2О7). Продуктом гідролізу є Н+ , який створює кислу рекцію розчину. Для усунення заважаючої дії Н+ додають СН3СООNа.
3)конц. НСl або HNO3 осаджують з досить концентрованих розчинів солей Ва чисті солі.
4) K4[Fe(CN)6]- калій гексаціаноферат (2)з Ва2+ утворює білий осад:
Вa2+ NH4+ +К+ + [Fe(CN)6]4-®Ва(NН4)К[Fe(CN)6]¯;
5) р-ція на забарвлення полум’я – жовто-зелений колір.
Питання 3
ДИТИЗОН 
(дифенілтіокарбазон, H2Dz) C2H5N=NC(S) NHNHC6H5, ; чорні, пурпурно-чорні або синьо-чорні кристали; т. пл. 168°З; не розч. у воді, дуже мало розч. у етанолі, діетиловому ефірі, розч. у СНСl3 реагент для екстракційно-фотометрич. визначення і концентрації у вигляді однозаміщених дитизонатів катіонів металів, в т. ч. Ag(I), Au(III), Bi(III), Cu(I, II), Fe(II), Hg(I, II),
Диметилгліоксим  (р-ктив Чугаєва) застосовують для якісного і кількісного визначення нікелю. Як селективний реагент на нікель диметилгліоксим запропонований в 1905 Л. А. Чугаевым, тому диметилгліоксим іноді називають "реактив Чугаева".
(р-ктив Чугаєва) застосовують для якісного і кількісного визначення нікелю. Як селективний реагент на нікель диметилгліоксим запропонований в 1905 Л. А. Чугаевым, тому диметилгліоксим іноді називають "реактив Чугаева".
При взаємодії з іонами нікелю диметилгліоксим утворює червоний комплекс, який може бути легко обложений і визначений гравіметрично.
NiCl2 + NH3×Н2О®[Ni(NH3)6]Cl2 + H2O
[Ni(NH3)6]Cl2 + H2Dm + 4H2O®Ni(HDm)2¯ + 2NH4Cl + 4NH3×Н2О
Алізарин(1,2-дигідроксиантрахінон) 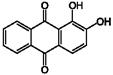 - оранжево-червоні кристали(голки) триклінної або ромбічної системи. У аналітичній хімії алізарин служить реагентом для визначення іонів алюмінію і ряду інших елементів.
- оранжево-червоні кристали(голки) триклінної або ромбічної системи. У аналітичній хімії алізарин служить реагентом для визначення іонів алюмінію і ряду інших елементів.
Al3+ + H2Alis + 3OH-®Al(OH)2(HAlis) + H2O
8-оксихінолін(оксихінолін, оксин) - гетероциклічна органічна сполука складу C9H7NO. Ясно-жовті кристали; 
Здатність 8-оксихіноліна утворювати з багатьма катіонами металів малорозчинні у водних розчинах(оцтової кислоти, аміаку та ін.) кристалічні внутрішньокомплексні солі(хелати), наприклад Mg(C9H6ON) 2, Al (C9H6ON) 3, використовується на практиці для визначення і розділення ряду металів (Al, Zn, Cd, Mg та ін.).
1-нітрозо-2-гідроксинафталін з солями кобальту(3)утворює пурпурно-червоний осад, який не розчиняється в холодних HNO3, HCl, але розчиняється в орган. Розчинниках етанол,ефір.
2СоCl2 + 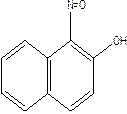 + 1/2О2®
+ 1/2О2® 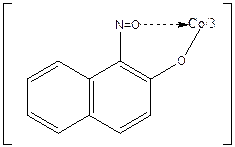 +4HCl+H2O
+4HCl+H2O
Питання 4-задача
МЕ(СаCl2)=1/2*111г/моль=55,5г/моль;
m= МЕ*CЕ*V/1000=55,5*0,4*500/1000=11,1г;
Т= m/V=11,1/1000=0,111г/см3.
Білет 4
3. Кристалічний осад -це осад з порівняно сильними звязками між його частинками. Утворення кристалічних осадів характеризується тим, що при додаванні окремих порцій осаджувача нові центри кристалізації утворюються не відразу. Основною умовою отримання кристалічних осадів є повільне додавання реактиву, при якому кристалічні центри виростають у порівняно великі кристали.
Для осадження кристалічних осадів користуються розбавленими розчинами, так як у цих умовах утворюються осади у формі більших кристалів. При осаджуванні кристалічних осадів з гарячих розчинів збільшується їх розчинність, тому виникає менше центрів кристалізації. Внаслідок цього створюються умови для утворення крупніших кристалів.
Приклади: BaSO4, BaCrO4, CaC2O4 та ін.
Аморфний осад характеризується слабкими звязками між його частинками. По суті це коагульований внаслідок швидкого доливання розчину осаджувача колоїдний розчин. При швидкому доливанні реактиву є основною умовою отримання аморфного осаду, відразу виникає багато центрів кристалізації та дрібних агрегатів кристалів. Аморфні осади, особливо гідроксиди металів, краще осаджувати з концентрованих розчинів. Це сприяє зменшенню загальної поверхні і утворенню осаду. Внаслідок зменшення загальної поверхні зменшується адсорбція сторонніх речовин, що робить осади чистішими.
При осаджуванні аморфних осадів нагрівання сприяє коагуляції колоїдних частинок і укрупненню зерен осаду.
Аморфні осади характерні для багатьох важкорозчинних сполук: гідроксидів та сульфітів металів, силікатної та вольфрамової кислот, та інших.
При осадженні кристалічних осадів необхідно виконувати певні умови:
1. осаджувати тільки з розведених розчинів розведеними розчинами осаджувача. Це уповільнює випадення осаду і попереджає забруднення осаду
2. осаджувати лише підігріті розчини гарячими розчинами осаджувачів, що також уповільнює процес утворення осаду і робить його більш крупнокристалічним
3. приливати осаджувач по краплям при постійному перемішуванні скляною паличкою, що зменшує можливість адсорбції йонів осаджувача осадом.
При осадженні аморфних осадів необхідно виконуючи такі умови:
1. осаджувати тільки з концентрованих розчинів при нагріванні
2. застосовувати осаджувач у вигляді концентрованого розчину і додавати його швидко
3. добавляти після осадження аморфного осаду 150 мл гарячої води і швидко фільтрувати, щоб не відбулася пептизація колоїда
Умови утворення і випадіння осадів під час проведення аналітичних реакцій: осад малорозчинного сильного електроліту утворюється тоді, коли після змішування розчинів реагентів добуток молярних концентрацій катіонів і аніонів (IД) буде більшим, ніж добуток розчинності (ДР), тобто коли
IД > ДР. Наприклад, осад барій сульфату буде випадати тоді, коли:
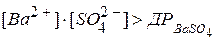 - розчин пересичений, переважає процес
- розчин пересичений, переважає процес
осадження, де 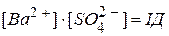 . Якщо
. Якщо 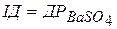 - динамічна рівновага; при
- динамічна рівновага; при 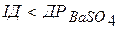 - розчин ненасичений, осад не випадатиме, а буде переважати процес розчинення осаду.
- розчин ненасичений, осад не випадатиме, а буде переважати процес розчинення осаду.
У загальному вигляді для електроліту 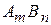 , який дисоціює
, який дисоціює
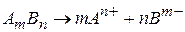
добуток розчинності матиме вигляд

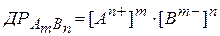 ,
,
де 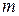 і
і 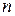 – стехіометричні коефіцієнти в рівнянні дисоціації електроліту.
– стехіометричні коефіцієнти в рівнянні дисоціації електроліту.
Наприклад, для солі 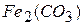 , що дисоціює, як
, що дисоціює, як
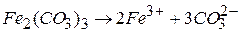
добуток розчинності буде таким
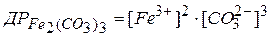 .
.
1. Титрування – це процес поступового добавляння розчину відомої концентрації з бюретки до розчину речовини, що визначається. Розчин, концентрація якого відома з високою точністю, називається титрованим, стандартним, робочим або титрантом. Титрування ведуть до досягнення точки еквівалентності – це момент, коли речовини прореагують у відповідності до закону еквівалентів. Точку еквівалентності встановлюють за допомогою індикаторів. Індикатор – це речовина, яка за певних умов змінює свій колір. Вибір індикатору залежить від типу реакції.
Вимоги до реакцій в титриметричному аналізі
Реакції в титриметричному аналізі повинні задовольняти наступним вимогам:
1. Реакції повинні проходити стехіометрично, тобто, проходити згідно з рівнянням реакції.
2. Реакції повинні проходити кількісно, тобто, повнота проходження повинна складати не менше 99,9%.
3. Стандартний (титрований) розчин реактиву повинен реагувати тільки з речовиною, що визначається, тобто, реакція повинна бути специфічною.
4. Реакція між титрованим розчином і розчином речовини, що визначається, повинна проходити з великою швидкістю.
5. Необхідно мати надійний спосіб фіксування точки еквівалентності.
6. В розчині повинні бути відсутніми речовини, що заважають проходженню основної реакції або не дають можливості фіксувати точку еквівалентності.
Класифікація методів титриметричного аналізу
В залежності від типу реакції, що лежить в основі титрування, розрізняють наступні методи аналізу.
1. Метод кислотно – основного титрування
В основі цього методу лежать кислотно – основні реакції, пов’язані із зміною кислотності розчину у процесі титрування. Різка зміна рН спостерігається у точці еквівалентності. Для її фіксації використовують рН-індикатори, які змінюють своє забарвлення в залежності від рН розчину.
2. Метод окисно – відновного титрування
В основі цього методу лежать реакції окиснення – відновлення. В процесі титрування змінюється потенціал розчину. Для визначення точки еквівалентності використовують окисно – відновні (редокс) індикатори, які змінюють своє забарвлення в залежності від потенціалу розчину.
3. Метод осадження і комплексоутворювання
Титриметричні методи аналізу з використанням реакцій осадження і комплексоутворювання об’єднані в одну групу методів, оскільки багато реакцій осадження за певних умов є і реакціями комплексоутворювання, і навпаки, реакції комплексоутворювання закінчуються утворенням малорозчинних сполук.
Точку еквівалентності в цих методах визначають як індикаторними, так і без індикаторними методами.
За способом титрування розрізняють методи прямого і непрямого титрування.
В методах прямого титрування йон чи компонент, що визначається, титрують титрованим розчином або навпаки.
До методів непрямого титрування належать метод заміщення та метод зворотного титрування (метод залишків).
Метод заміщення полягає в тому, що йони, які визначаються, заміщують еквівалентною кількістю інших йонів, які вже можна визначити прямим титруванням. Цей метод використовують, якщо є труднощі з фіксацією точки еквівалентності.
Метод зворотного титрування (метод залишків) полягає в тому, що до аналізуємого розчину додають точно відомий надлишок титрованого розчину реактиву і титрують цей надлишок відповідним робочим розчином. Метод застосовують в тому випадку, коли немає відповідного індикатора для визначення точки еквівалентності, або, коли реакція проходить надто повільно.
Розрахунки в титриметричному аналізі
1. Розрахунок маси наважки, необхідної для приготування заданого об’єму стандартного розчину відомої концентрації
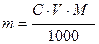 , (5.6)
, (5.6)
де C-молярна концентрація еквівалента стандартного розчину, моль-екв/л; 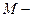 молярна маса еквівалента речовини, г/моль-екв;
молярна маса еквівалента речовини, г/моль-екв; 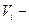 об’єм розчину, мл.
об’єм розчину, мл.
2. Розрахунки вмісту речовини за методом окремих наважок при прямому титруванні
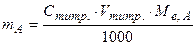 ; (5.7)
; (5.7)
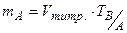 ; (5.8)
; (5.8)
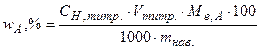 , (5.9)
, (5.9)
де 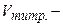 об’єм титрованого розчину, мл;
об’єм титрованого розчину, мл; 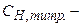 молярна концентрація еквівалента титрованого розчину, моль-екв/л;
молярна концентрація еквівалента титрованого розчину, моль-екв/л; 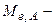 молярна маса еквівалента речовини, що визначається, г/моль-екв;
молярна маса еквівалента речовини, що визначається, г/моль-екв; 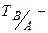 титр титрованого розчину В за речовиною А, г/мл;
титр титрованого розчину В за речовиною А, г/мл; 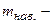 маса наважки, г.
маса наважки, г.
4. Розрахунки вмісту речовини при зворотному титруванні
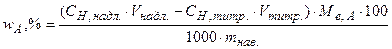 , (5.11)
, (5.11)
де 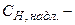 молярна концентрація еквівалента титрованого розчину, надлишок якого додається до аналізуємого розчину, моль-екв/л;
молярна концентрація еквівалента титрованого розчину, надлишок якого додається до аналізуємого розчину, моль-екв/л; 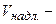 об’єм надлишкового титрованого розчину, мл;
об’єм надлишкового титрованого розчину, мл; 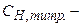 молярна концентрація еквівалента титрованого розчину, яким титрується надлишок, моль-екв/л;
молярна концентрація еквівалента титрованого розчину, яким титрується надлишок, моль-екв/л; 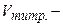 об’єм цього титрованого розчину, мл;
об’єм цього титрованого розчину, мл; 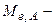 молярна маса еквівалента речовини, що визначається, г/моль-екв;
молярна маса еквівалента речовини, що визначається, г/моль-екв; 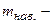 маса наважки, г.
маса наважки, г.
5. Розрахунки молярної маси еквівалента
- кислоти 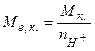 , (5.12)
, (5.12)
де 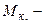 молярна маса кислоти, г/моль;
молярна маса кислоти, г/моль; 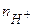 - число йонів Н+, що містить кислота;
- число йонів Н+, що містить кислота;
- основи 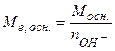 , (5.13)
, (5.13)
де 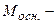 молярна маса основи, г/моль;
молярна маса основи, г/моль; 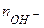 - число йонів ОН-, що містить основа;
- число йонів ОН-, що містить основа;
- солі 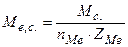 , (5.14)
, (5.14)
де 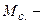 молярна маса солі, г/моль;
молярна маса солі, г/моль; 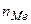 - кількість йонів металу;
- кількість йонів металу; 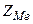 - заряд йонів металу.
- заряд йонів металу.
Для окисно-відновних реакцій молярна маса еквівалента речовини, що приймає в ній участь, розраховується за рівнянням
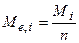 (5.15)
(5.15)
де 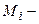 молярна маса речовини, г/моль;
молярна маса речовини, г/моль; 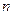 - кількість електронів, що приймає участь в окисно-відновному процесі цієї речовини.
- кількість електронів, що приймає участь в окисно-відновному процесі цієї речовини.
Основні операції титриметричних методів аналізу:
- приготування розчинів стандартної та аналізованої речовини.
- титрування
- обчислення
За способом приготування розрізняють первинні стандартні розчини і вторинні стандартні розчини- стандартизовані.
Стандартний розчин – це розчин з точно відомою концентрацією речовини або точно відомим титром.
Первинні стандартні розчини ( розчини з приготовленим титром): Na2B4O7 ∙ 10H2O, Na2CO3, K2Cr2O7, KCl, NaCl, Na2C2O4, H2C2O4 ∙ 2H2O.
Стандартизовані розчини: HCl, H2SO4, NaOH, KOH, KMnO4, Na2S2O3 ∙ 5H2O.
- Розв’язок
Допускають, що маса BaCl2 ∙ 2H2O = 0,1, оскільки осад кристалічний важчий за повітря
BaCl2 ∙ 2H2O - Ba
244 - 137,33
0,1 - x
X = 0,056 г
ω = m ( практ. вих ) / m ( теор вих.) ω = 56, 77%
X = 0, 056 / 0, 5677 = 0, 099 г. ( теор. вих.)
m (практ.в) = 0, 056 г.
m ( теор. в) = 0, 099 г.
⌂ m ( абсолютна) = │m (іст.) – m ( розр.) │
⌂ m = │0, 099- 0, 056│
ε = │0, 099- 0, 056│ / 0, 056 ∙ 100% =76, 78 %
1. Дія групового реактиву NaОН або КОН
Натрій гідроксид або калій гідроксид з катіонами четвертої аналітичної групи утворюють аморфні осади гідроксидів, за винятком сполук As(III) і Аs(V) :
[Сг(OH2)6]3- + 3OH- → [Cr(OH2)3(OH)3]↓ + 3H2O
[Al(OH2)6]3+ + 3OH- → [Al(OH2)3(OH)3]↓ + 3H2O
[Zn(OH2)4]2+ + 2OH- → [Zn(OH2)2(OH)2]↓ + 2H2O
[SnCl4]2- + 2OH- → Sn(OH)2↓ + 4Cl-
Sn2+ + 2OH- → Sn(OH)2↓ або SnO ∙ xH2O
[SnCl6]2- + 4OH- → Sn(OH)4↓ + 6Cl-
Sn4+ + 4OH- → Sn(OH)4↓ або SnO2 ∙ xH2O
As3+ + 4OH- → [As(OH)4]-
As3+ + 6OH- → [As(OH)6]-
Хром(ІІІ)-катіон
1. Окиснення хром(ІІІ)-катіона до Сr(VI) різними окисниками
а) Окиснення хром(ІІІ)-катіона гідроген пероксидом - Н2О2 у лужному середовищі:
2Сr,3+ + 3Н2O2 + 10 ОH- → 2СrO42- + 8Н2O
2 | Сr3+ + 8OН- - Зе = СrO42- + 4Н2O
3 | H2O2 + 2e = 2OH-
б) Окиснення хром(Ш)-катіона КМnO4 (калій тетрaоксоманганатом(VІІ)) у кислому середовищі:
10 Сr3+ + 6МnO4- + 11Н2О → 5Сr2O72- + 6Mn2+ + 22Н+
5 | 2Сr3+ + 7Н2O - 6е = Сr2O72- + 14Н+
6 | МnО4- + 8Н+ + 5е = Мn2+ + 4Н2O
Умови реакції:
а) середовище сульфатної(УІ) кислоти;
в) Окиснення хром(ІІІ)-катіона (NH4)2S2O8 або К2S2O8 - диамоній або дикалій гексаоксопероксодисульфатом(VІ) у присутності каталізатора (AgNO3) і нітратної(V) кислоти:
2Сr3+ + 3S2O82- + 7Н2O → Сr2O72- + 6SO42- + 14Н+
1 | 2Cr3+ + 7H2O – 6e = Cr2O72- +14H+
3 | S2O82- + 2e = 2SO42-
2. Хромат(VІ)- або дихромат(VІ)-іони у кислому розчині окиснюють
йодид-іон, відновлюючись, до хром(ІІІ)- катіона:
6I- + Сr2O72- + 14Н+ = 3І2 + 2Сr3+ + 7Н2O
3 | 2I- - 2е = І2
1 | Сr2O72- + 6e + 14Н+ = 2Сr3+ + 7Н2O
4. Арґентум(І)-, барій- і плюмбум(ІІ)-катіони осаджують хромат (VІ)-іон з розчинів, утворюючи забарвлені осади:
2Аg+ + СrО42- → Аg2СrO4↓
Ва2+ + СrO42- → ВаСrO4↓
Рb2+ + СrO42- → РbСrО4↓
Реакції виконують краплинним методом.
9. ЕДТА - Nа2Н2Y∙2Н2O - динатрій етилендиамінтетраацетат-вода(1/2) з хром(ІІІ)-катіоном у слабкокислому середовищі утворює координаційну сполуку фіолетового кольору СrY- де Y4- - аніон ЕДТА:
Сr3+ + Н2Y2- → СrY- + 2Н+
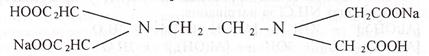
Умови реакції:
а) рН 4-5; б) надлишок ЕДТА; в) відсутність Fе3+-, Сu2+-, Со2+-, Ni2+-іонів тощо, які мають хромофорні властивості; г) відсутність оксалат- і цитрат-аніонів; д) нагрівання.
1.Гідроліз гексагідроксоалюмінатів(ІІІ) у присутності амоній хлориду
NН4С1 за нагрівання:
[А1(ОН2)6]3+ + 3ОН- → [А1(ОН2)3OH)3]↓ + 3H2O
[А1(ОН2)3OH)3] + 3ОН- → [А1(ОН)6]3- + 3H2O
[А1(ОН)6]3- + NH4+ + 2H2O → [А1(ОН2)3OH)3]↓ + NH3↑ + 3H2O
2. Алізарин (H2Alis, 1,2-диоксіантрахінон, С12Н6(СО)2(ОН)2) з амюміній-катіоном утворює червоний «алюмінієвий лак», який не розчиняється в ацетатній, або в етановій, кислоті):
Al3+ + H2Alis + 3OH- → Al(OH)2(HAlis) + H2O

Алізарин
- 8-Оксихінолін (НОхіn) з алюміній-катіоном утворює нерозчинний у воді, але добре розчинний у органічних розчинниках алюміній оксихінолят солом'яно-жовтого кольору
Цинк(ІІ)-катіон
1. К4[Fе(CN)6]4- з Zn2+-іоном утворює білий осад, який не розчиняється в розведених кислотах, але розчиняється в лугах:
3Zn2+ + 2К+ + 2[Fе(СN)6]4- → К2Zn3[Fе(СN)6]2↓
2.К3[Fе(СN)6] з Zn2+-катіоном утворює осад коричнево-жовтого кольору, який розчиняється в лугах:
3Zn2+ + 2[Fe(CN)6]3- → Zn3[Fe(CN)6]2↓
Н2S з Zn2+-катіоном у присутності натрій ацетату утворює білий драглистий осад, який не розчиняється в СН3СООН:
Zn2+ + Н2S + 2СН3СОО- → ZnS↓ + 2СН3СООН
4. Дитизон (дифенілтіокарбазон, C6H5-NH-NH-CS-N=N-C6H5, H2Dz)
Н2Dz + 2OН- + 2Nа+ → Na2Dz + 2Н2O
Станум(ІІ)-катіон
2. Бісмут(ІІІ)-катіон у лужному середовищі окиснює станум(ІІ)-катіон до станум(ІV)-катiона, відновлюючись до оксамитово-чорного металічного бісмуту:
Sn2+ + 2OН- → Sn(ОН)2↓
Sn(ОН)2 + 2OН-  [Sn(ОH)4]2-
[Sn(ОH)4]2-
3[Sn(ОН)4]2- + 2Ві(ОН)3 → 3[Sn(ОН)6]2- + 2Вi↓
6. Н2S - гідроген сульфід або Nа2S - натрій сульфід з Sn2+- іоном утворює темно-коричневий осад SnS, який не розчиняється в надлишку реактиву (Н2S чи Nа2S).
Sn2+ + Н2S → SnS↓ + 2Н+
хлоридній кислоті губчасте олово може знову розчинитися.
5. Оксалатна (щавлева) кислота - Н2С2O4∙2Н2O з нейтрального або слабкокислого розчину станум(ІІ)-катіона осаджує станум(ІІ) оксалат:
Sn2+ + Н2С2O4 → SnC2O4↓ + 2Н+
Станум(IV)-катіон
1. Гідроліз солей станум(IV)-катіона
Найповніше SnСl4 гідролізує за нагрівання і у присутності нітратних(V) або сульфатних(VІ) солей:
[SnСl6]2- + 4НОН → Sn(ОН)4 ↓+ 4Н+ + 6Сl-
3.Н2S - сульфідна кислота з Sn(ІV)-катіоном утворює жовтий осад:
[SnСl6]2- + 2Н2S → SnS2↓ + 4Н+ + 6Сl-
Осад розчиняється в концентрованій хлоридній кислоті, в лугах і Na2S:
SnS2 + 6НСlконц → Н2[SnСl6] + 2Н2S↑
Білет 5
1. КИСЛОТНО-ОСНОВНЕ ТИТРУВАННЯ (метод нейтралізації)
титриметричний метод аналізу, в основі якого (у водному середовищі) лежить реакція нейтралізації: H3O+ + OH-  2H2O.
2H2O.
Реакції кислотно-основної взаємодії характеризуються великою швидкістю і проходять строго стехіометрично.
Стандартними розчинами методу є 0,1 М…0,001 М розчини HCl, H2SO4, NaOH, KOH. Якщо як титранти використовують розчини кислот, то метод називають ацидиметрією, а якщо основи — алкаліметрією.
1) Ацидиметричне титрування:
- Титрують сильні основи (наприклад, NaOH, KOH, Ba(OH)2 тощо):
OH- + H+ = H2O
- Титрують слабкі основи (наприклад, NH3H2O):
NH3H2O + H+ = NH4+ + H2O
- Титрують солі неорганічних і органічних кислот, які гідролізують з утворенням ОН- йонів (наприклад, Na2CO3, NaHCO3, CH3COONa тощо):
СО32- + HOH = HCO3- + OH-
H+ + OH- = H2O
В алкаліметричному титруванні титрантами є водні розчини NaOH і KOH з молярною концентрацією речовини еквівалента 1 моль/дм3, 0,5 моль/дм3, 0,1 моль/дм3, 0,01 моль/дм3 (fекв (МОН) = 1). Рідше використовують розчини барій дигідроксиду Ba(OH)2 (fекв (Ba(OH)2 = ½).
2) Алкаліметричне титрування:
- Титрують сильні кислоти (наприклад, HCl, H2SO4, HNO3 тощо):
H+ + OH- = H2O
- Титрують слабкі кислоти (наприклад, ортофосфатна(V), ацетатна, тартратна, оксалатна тощо):
H3PO4 + OH- = H2PO4- + H2O (індикатор метилоранж)
- Титрують солі , які гідролізують з утворенням гідроген (1+)-йонів (наприклад, NH4Cl тощо):
NH4+ + H2O = NH3H2O + H+, H+ + OH-= H2O
- Титрують гідроген-солі (наприклад, NaH2PO4, Na2HPO4 тощо):
H2PO4- = HPO42- + H+
H2PO4- + OH- = HPO42- + H2O (індикатор фенолфталеїн)
2HPO42- + 2OH- + 3Са2+ = Ca3(PO4)2↓ + 2H2O (індикатор фенолфталеїн)
Використовують вторинні стандартні розчини; їх точну молярну концентрацію встановлюють за стандартними речовинами або при їх титруванні розчинами відомої концентрації. Стандартизацію розчинів кислот проводять за стандартними речовинами: натрію тетраборатом (Na2B4O7⋅10H2O), натрію карбонатом (Na2CO3) або за стандартними розчинами лугів (NaOH та KOH). Стандартизацію розчинів лугів проводять за стандартними речовинами: оксалатною кислотою (H2C2O4), бурштиновою кислотою (H2C4H4O4), янтарною, за стандартними розчинами HCl, H2SO4.
Прийоми кислотно-основного титрування:пряме, зворотне, титрування із замісником.
Способи виконання операцій:піпеткування, окремих наважок.
У методах кислотно-основного титрування ТЕ (ТЕ – момент, коли речовини прорегували між собою в точних еквівалентних кількостях) не супроводжується видимим зовнішнім ефектом і може лежати в нейтральному, лужному і кислому середовищі. Тому для визначення ТЕ використовують кислотно-основні індикатори.
Індикатори– це органічні сполуки, які змінюють свою будову і фізичні властивості (колір) залежно від зміни величини рН середовища. Тому такі індикатори називають рН-індикаторами (наприклад, лакмус, фенолфталеїн, метиловий оранжевий, метилчервоний).
Випадки титрування:
1) Титрування сильної кислоти сильною основою (чи навпаки);
2) Титрування слабкої кислоти сильною основою (чи навпаки);
3) Титрування слабкої основи сильною кислотою.
Приклади визначень:
- Ацтдиметрія
1. Визначення вмісту натрій гідроксиду у розчині невідомої концентрації способом піпеткування.
2. Визначення вмісту натрій гідроксиду і натрій карбонату при спільній їх присутності.
3. Визначення вмісту амоніаку у водному розчині його
4. Визначення вмісту натрій карбонату і натрій гідроген карбонату при спільній їх присутності способом піпеткування.
5. Визначення карбонатної(тимчасової) твердості води.
- Алкаліметрія
1. Визначення вмісту гідроген хлориду і тригідроген триоксоборату при спільній їх присутності у розчині.
2. Визначення кислотності хліба.
3. Визначення кислотності молока.
4. Визначення вмісту ацетатної (етанової) кислоти у зразках її.
5. Визначення загального вмісту фосфору в суперфосфаті.
6. Визначення вмісту калію в калійних добривах.
2. Катіони четвертої аналітичної групи –Cr3+, Al3+, Zn2+,Sn2+,Sn4+,As3+,
As5+- утворюють хімічні елементи різних груп і підгруп періодичної таблиці; утворюють типові амфотерні елементи.
Близькі електронна будова і радіус катіонів четвертої аналітичної групи обумовлюють однакове відношення їх до сильних основних гідроксидів – лугів.
Дія групового реактиву NaOH або KOH (NH4OH) :
Меn+ + nOH- = Me(OH)n↓
Zn2+ + 2ОН- = Zn( ОН )2↓ (білий); Al3+ + 3OH- = Al(OH)3↓ (білий);
Zn( ОН )2↓ + 2ОН- = [Zn( OH )4]2-; Al(OH)3↓ + 3OH- = [Al(OH)6]3-.
1) Солі Cr3+ мають зелене або синьо-фіолетове забарвлення.
Окиснення Cr3+ до Cr6+ різними окисниками:
2Cr3+ + 3H2O2 + 10OH- = 2CrO42- +8H2O (жовтий колір)
2CrCl3 +3H2O2 + 10NaOH = 2Na2CrO4 +8H2O + 6NaCl.
10Cr3+ + 6MnO4- +11H2O = 5Cr2O72- + 6Mn2+ + 22H+(жовто-оранжевий)
2Cr2(SO4)3 + 6KMnO4 +11H2O = 5H2Cr2O7 + 6MnSO4 +3K2SO4 +6H2SO4.
2Cr3+ + 3S2O82- + 7H2O =AgNO3 Cr2O72- + 6SO42- + 14H+
Cr2(SO4)3 + 3(NH4)2S2O8 + 7H2O =AgNO3 (NH4)2Cr2O7 + 3(NH4)2SO4 + 7H2SO4.
2) Al3+ + H2Alis + 3OH- =Al(OH)2(HAlis) + H2O (червоний «алюмінієвий» лак)
 алізарин
алізарин 
3) Солі Zn2+ безбарвні, більшість з них розчинні у воді.
3Zn2+ + 2К+ + 2[Fe(CN)6]4- = K2Zn3[Fe(CN)6]2↓(білий)
3ZnSO4 + 2К4[Fe(CN)6] = K2Zn3[Fe(CN)6]2↓ + 3K2SO4
Zn2+ + S2- = ZnS↓(білий)
ZnCl2 + (NH4)2 S = ZnS↓+ 2NH4Cl
4) (Sn2+,Sn4+,As3+,As5+) + H2S =
SnS↓ - осад темно-коричневого кольору;
SnS2↓- жовтий;
As2S3↓( As2S5↓) - осад світло-жовтого кольору;
5) Магнезіальна суміш (MgCl2 + NH3 H2O + NH4Cl) на As5+:
Mg2+ + NH4+ + AsO43- = MgNH4AsO4↓(білий кристалічний осад).
Молібденова рідина в кислому середовищі на As5+:
H3AsO4 + 12MoO42- + 3NH4+ +21H+ = (NH4)3[As(Mo3O10)4] 2H2O↓ +10H2O (жовтий кристалічний осад).
3. Гетерогенна система –це система,яка складається з кількох фаз.
Найпростішою гетерогенною системою є малорозчинний електроліт, що утворює насичений розчин, який складається з осаду та розчину, які перебувають у стані хімічної рівноваги:
ВаSO4↓ = BaSO4 = Ba2+ + SO42- - насичений розчин малорозчинного електроліта.
Фактори, що впливають на розчинність речовин:
1) Наявність однойменних йонів і сильних електролітів;
2) Температура;
3) рН- середовище;
4) Природа розчинника;
5) Присутність комплексоутворювачів, окисників, або відновників.
Добуток розчинності – це добуток молярних концентрацій йонів у насиченому розчині малорозчинного електроліту за стлої температури і тиску.
Таким чином, малорозчинні речовини – це сильні електроліти, оскільки у водних розчинах існують у вигляді йонів.
Фізичний зміст рівняння ДР:незалежно від зміни молярної концентрації окремих йонів у розчині значення ДР завжди залишається сталим за сталої температури.
ДР (BaSO4) = [Ba2+][SO42-]
Добуток активності:ДА = ДР/y2, у – коефіцієнт активності відповідного малорозчинного електроліта.
ДА не залежить від концентрації, сторонніх йонів, від температури.
Правило ДР:осад малорозчинного електроліта осаджується тоді, коли досягнуто і перевищено величину його добутку розчинності.
- З підвищенням температури розчинність осадів збільшується;
- При збільшенні РН (зниженні рОН) розчинність осадів збільшується.
Дробне осадження: електроліт, який має найнижчий ДР осаджується першим. При близьких значеннях ДР можливе утворення декількох осадів малорозчинних електролітів і здійснюється пропорційно до величини ДР.
4.
| Дано: m(наважки) = 0,2017г. m(тигля з Fe2O3) = 10,4954г. m(порожнього тигля) = 10,2124г. | Розв’язання: 1) Яка маса гравіметричної форми? m (Fe2O3) =10,4954 – 10,2124 = 0,283г. 2) Яка масова частка (у%) Феруму у пробі? W(%)(Fe) = [m(Fe2O3) х [F(2M(Fe)/M(Fe2O3))] х 100%/ m(наважки) = 0,283г. х 0,6994 х 100%/ 0,2017г. = 98,130 |
W(%)(Fe) - ?
Відповідь: W(%)(Fe) = 98,13
Білет № 6
