Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса.
Требования к знаниям и умениям студентов
| ЗНАТЬ | УМЕТЬ |
| 1.знать определения важнейших понятий (атом, ион, молекула, химический элемент, валентность, степень окисления, заряд иона, химическая связь, π- и σ-связи, ковалентная связь, электроотрицательность, полярная и неполярная связь, ионная связь, металлическая связь, кристаллическая решетка) | 1.уметь правильно использовать понятия при ответах. |
| 2.знать, как образуется ковалентная связь (обменный и донорно-акцепторный механизм) и за счет чего осуществляется, как образуется σ- и π- связь, кратность связи, от чего зависит полярность ковалентной связи, для каких элементов характерно образование ковалентной связи | 2.уметь определять наличие ковалентной связи в соединениях, определить ее полярность, кратность, наличие σ- и π- связи, механизм образования и оценивать прочность связи |
| 3. знать правила составления электронных и структурных формул соединений и схем образования ковалентной связи | 3. уметь составлять схемы образования ковалентной связи, записывать электронные и структурные формулы соединений, обозначать полярность, кратность связи |
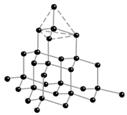
| 4. знать типы кристаллической решетки которые могут образовывать вещества с ковалентной связи (атомная (каркасная, слоистая, цепочечная) и молекулярная), физические свойства веществ с данным видом решетки | 4. определять тип кристаллической решетки, описывать физические свойства веществ с молекулярной и атомной решеткой, приводить примеры таких веществ |
| 5. знать механизм образования ионной связи, за счет чего осуществляется, между какими элементами она образуется, чем похожа и чем отличается от ковалентной связи; кристаллическая ионная решетка: частицы, которые ее образуют, взаимодействие между ними, прочность решетки, свойства веществ, имеющих ионное строение | 3. уметь условно обозначать ионы и писать для них электронные формулы; рисовать схему образования ионной связи, обозначать заряды ионов, объяснять сходство и различие ионной связи и ковалентной, описывать физические свойства веществ с ионной решеткой, оценивать ее прочность в зависимости от от типа решетки и заряда ионов |
| 6. знать, как образуется связь в простых веществах металлах, особенности строения кристаллической решетки металлов и металлической связи, общие физические свойства металлов, обусловленные металлической связью | 4. уметь объяснять общие физические свойства металлов на основании строения кристаллической решетки и особенностей образования металлической связи. |
| 7. знать правила определения степеней окисления в различных соединениях | 5. уметь определять степень окисления в соединениях, составлять формулы веществ с определенной степенью окисления и называть их |
| 8.знать понятия ОВР, окислитель и окисление, восстановитель и восстановление, правила расстановки коэффициентов в ОВР методом электронного баланса | 6. уметь определить является ли реакция ОВР, определять какой из элементов является окислителем, а какой восстановителем, когда и за счет чего протекает окислительный или восстановительный процесс, сколько электронов теряет или при приобретает элемент при изменении степени окисления элемента, расставлять коэффициенты в ОВР методом электронного баланса |
| 9. знать за счет чего образуется водородная связь внутри молекулы и между молекулами, межмолекулярное взаимодействие (силы Ван-дер-Ваальса) | 7.уметь объяснять появление водородной связи в веществах, и изменения физических свойств, которые из-за этого происходят, приводить примеры веществ с внутримолекулярной и межмолекулярной водородной связью |
Теория.
План.
1. Понятие о химической связи. Виды связи: ковалентная, ионная, металлическая. Свойства связи: направленность, кратность, длина, полярность. Структурные и электронные формулы вещества.
6. Кристаллические решетки. Зависимость свойств веществ от типа кристаллической решетки.
7. Степень окисления. Окислительно-восстановительные процессы.
Только инертные газы в стандартных условиях находятся в одноатомном состоянии. Все остальные элементы, стремясь завершить свой внешний электронный слой, образуют химические связи. Это стремление иметь 8 электронов на внешнем слое называют правилом октета. Обычно, перед тем как вступить в химическую реакцию атом должен получить дополнительную энергию и перейти в возбужденное состояние.
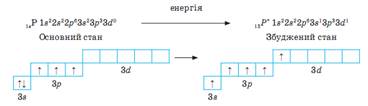 Химическая связь имеет электронную природу, т.е. образуется за счет взаимодействия между ядрами и электронами атомов. Существует несколько видов химической связи.
Химическая связь имеет электронную природу, т.е. образуется за счет взаимодействия между ядрами и электронами атомов. Существует несколько видов химической связи.
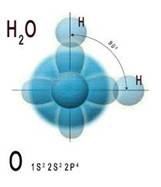
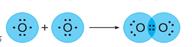
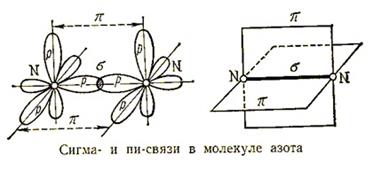
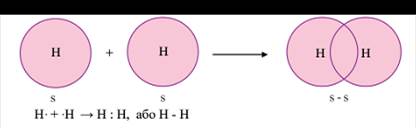 Ковалентная связь образуется за счет общих электронных пар. Она характерна для неметаллов, т.е. элементов с высокой ЭО, которые завершают свой внешний электронный слой за счет чужих электронов. Обычно ковалентная связь образуется за счет неспаренных электронов внешнего электронного слоя. Химическая связь – это зона повышенной электронной плотности, которая возникает между ядрами двух атомов за счет перекрывания электронных облаков и притягивает их, образуя из отдельных частиц единое целое. Так перекрываются s и p орбитали в молекулах водорода Н2 и хлора Cl2
Ковалентная связь образуется за счет общих электронных пар. Она характерна для неметаллов, т.е. элементов с высокой ЭО, которые завершают свой внешний электронный слой за счет чужих электронов. Обычно ковалентная связь образуется за счет неспаренных электронов внешнего электронного слоя. Химическая связь – это зона повышенной электронной плотности, которая возникает между ядрами двух атомов за счет перекрывания электронных облаков и притягивает их, образуя из отдельных частиц единое целое. Так перекрываются s и p орбитали в молекулах водорода Н2 и хлора Cl2

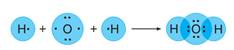 Возможно и перекрывание орбиталей s и p, например, в молекуле воды. И во всех этих случаях область повышенной электронной плотности находится на прямой, которая соединяет центры атомов. Такую связь называют сигма-связь и обозначают буквой
Возможно и перекрывание орбиталей s и p, например, в молекуле воды. И во всех этих случаях область повышенной электронной плотности находится на прямой, которая соединяет центры атомов. Такую связь называют сигма-связь и обозначают буквой 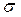 . Такую связь обозначают в электронных формулах веществ двумя точками (пара электронов), а в структурных формулах – черточкой. Н-О-Н
. Такую связь обозначают в электронных формулах веществ двумя точками (пара электронов), а в структурных формулах – черточкой. Н-О-Н
Но если связь образована не одной парой электронов, а двумя, то они не могут перекрываться на одной прямой. Одна пара электронов перекрывается на прямой соединяющей центы атомов и образует 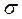 связь, а другая пара р-орбиталей, перекрывается своими боковыми сторонами. И тогда область повышенной электронной плотности лежит вне прямой, соединяющей центры атомов. Такая связь называют пи-связью (
связь, а другая пара р-орбиталей, перекрывается своими боковыми сторонами. И тогда область повышенной электронной плотности лежит вне прямой, соединяющей центры атомов. Такая связь называют пи-связью ( 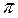 -связь).
-связь).

 Связь, образованная одной парой электронов, называется одинарной. Связь, образованная двумя парами электронов, называется двойной связью и изображается в электронной формуле двумя парами электронов, а в структурной формуле двумя черточками. О=О
Связь, образованная одной парой электронов, называется одинарной. Связь, образованная двумя парами электронов, называется двойной связью и изображается в электронной формуле двумя парами электронов, а в структурной формуле двумя черточками. О=О
Одна из связей всегда 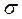 , а другая -
, а другая - 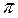 .
. 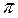 -связь менее прочная чем
-связь менее прочная чем 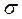 . Но она «жесткая», т.е. вокруг нее невозможно свободное вращение атомов, образующих связь.
. Но она «жесткая», т.е. вокруг нее невозможно свободное вращение атомов, образующих связь.
Если связь образована тремя парами электронов, то она будет называться тройной связью. Тройная связь всегда состоит из одной 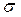 -связи и двух π-связей. Например:
-связи и двух π-связей. Например:
Структурную формулу азота поэтому изображают N≡N.
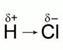
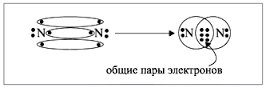
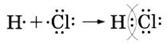 Различают ковалентную полярную связь и ковалентную неполярную связь (КП и КНП). Если атомы, образующие связь одинаковы, то электронная пара в равной степени принадлежит обоим атомам, и связь называют КНП. Если атомы разные, то электронная пара смещена к более ЭО атому, на атомах появляются частичные заряды, т.н. «полюса», связь называется КП. Элемент с большей ЭО приобретает частичный отрицательный заряд, элемент с меньшей ЭО – частичный положительный заряд. Ковалентная неполярная связь характерна для простых веществ неметаллов, а полярная – для их соединений. Ковалентная связь локализована в пространстве, у нее есть длина, есть определенный угол между связями, ее прочность характеризуется энергией, которая необходима для разрыва связи.
Различают ковалентную полярную связь и ковалентную неполярную связь (КП и КНП). Если атомы, образующие связь одинаковы, то электронная пара в равной степени принадлежит обоим атомам, и связь называют КНП. Если атомы разные, то электронная пара смещена к более ЭО атому, на атомах появляются частичные заряды, т.н. «полюса», связь называется КП. Элемент с большей ЭО приобретает частичный отрицательный заряд, элемент с меньшей ЭО – частичный положительный заряд. Ковалентная неполярная связь характерна для простых веществ неметаллов, а полярная – для их соединений. Ковалентная связь локализована в пространстве, у нее есть длина, есть определенный угол между связями, ее прочность характеризуется энергией, которая необходима для разрыва связи.
Если элементы очень сильно отличаются по ЭО, т.е. принадлежат один к металлам, другой к неметаллам, то электроны полностью переходят к более ЭО атому, образуются реальные заряды на атомах.
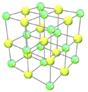
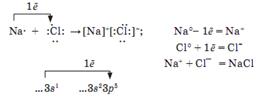 Атомы превращаются в ионы, которые связаны электростатическим взаимодействием. Связь между ионами называют ионной. Такая связь характерна для сложных веществ, образованных металлами и неметаллами. Ионная связь связывает все отрицательные ионы и все положительные ионы, а не конкретные атомы. Такая связь называется нелокализованной. Ионная связь менее прочная чем ковалентная.
Атомы превращаются в ионы, которые связаны электростатическим взаимодействием. Связь между ионами называют ионной. Такая связь характерна для сложных веществ, образованных металлами и неметаллами. Ионная связь связывает все отрицательные ионы и все положительные ионы, а не конкретные атомы. Такая связь называется нелокализованной. Ионная связь менее прочная чем ковалентная.
Простые вещества – металлы образуют особый вид химической связи, которую называют металлической. Она осуществляется валентными электронами, которые находятся в общем владении всех атомов металла (электронный газ).
Множество атомов соединяясь между собой образуют вещества. В твердом состоянии вещества могут иметь упорядоченную (кристаллическую) и неупорядоченную (аморфную) структуру. Модель кристаллического состояния вещества называют кристаллической решеткой. В зависимости от вида частиц, которые образуют кристаллическую решетку и типа химической связи в ней принято различать молекулярную, ионную, атомную и металлическую кристаллическую решетку. Чем прочнее связь между частицами, тем выше температура плавления вещества, больше твердость. Чем полярнее связи между частицами, тем больше вероятность растворения вещества в воде.

 Водородная связь(Н-связь)– особый тип взаимодействия между реакционноспособными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий.
Водородная связь(Н-связь)– особый тип взаимодействия между реакционноспособными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий.
Особенности водородной связи.Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми межмолекулярными взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе. В образовании Н-связи определяющую роль играет электроотрицательность участвующих в связи атомов – способность оттягивать на себя электроны химической связи от атома – партнера, участвующего в этой связи. В результате на атоме А с повышенной электроотрицательностью возникает частичный отрицательный заряд d- , а на атоме-партнере – положительный d+, химическая связь при этом поляризуется: Аd-–Нd+.
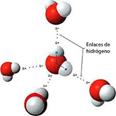 Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент, таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия. В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Нd+–Аd- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare – дарить, жертвовать), а Б – его акцептором (лат. acceptor – приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А.
Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент, таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия. В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Нd+–Аd- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare – дарить, жертвовать), а Б – его акцептором (лат. acceptor – приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А.
 Атомов – доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк. Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит при температуре намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение. Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As. Его истинная температура кипения (–33° С) на 80° С выше ожидаемого значения. При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи. Точно также повышенная температура кипения спиртов (в сравнении с соединениями, не содержащими группу -ОН) – результат образования водородных связей.
Атомов – доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк. Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит при температуре намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение. Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As. Его истинная температура кипения (–33° С) на 80° С выше ожидаемого значения. При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи. Точно также повышенная температура кипения спиртов (в сравнении с соединениями, не содержащими группу -ОН) – результат образования водородных связей.
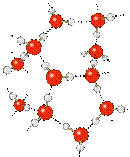
Помимо повышенной температуры кипения водородные связи проявляются себя также при формировании кристаллической структуры вещества, повышая его температуру плавления. В кристаллической структуре льда Н-связи образуют объемную сетку, при этом молекулы воды располагаются таким образом, чтобы атомы водорода одной молекулы были направлены к атомам кислорода соседних молекул
Важной характеристикой элемента является его степень окисления. Степень окисления - это условный заряд, который мог бы появиться на атоме, если бы все электроны образующие его химические связи сместились к более электроотрицательному атому.
Степень окисления элементов в простом веществе равна нулю.Примеры: Na0, H02, P04.
Есть элементы, которые могут иметь только одну с.о. (кроме 0), а есть элементы с переменной степенью окисления и ее надо уметь определять по формуле вещества. Сумма степеней окисления всех атомов в сложном веществе равна нулю, а в ионе – заряду иона..Алгоритм вычисления степени окисления аналогичен алгоритму вычисления валентности. Постоянную степень окисления имеют те же металлы, которые имели постоянную валентность. Причем по модулю эти величины совпадают. Отрицательную степень окисления элемента (а она тоже всегда одна) можно определить по ПС. Рассмотрим применение этого правила на простых примерах.
Пример 1. Необходимо найти степени окисления элементов в аммиаке (NH3).
Решение. Мы уже знаем, что с. о. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х - искомая степень окисления. Составляем простейшее уравнение: х + 3∙(+1) = 0. Решение очевидно: х = -3. Ответ: N-3H3+1.
Пример 2. Укажите степени окисления всех атомов в молекуле H2SO4.
Решение. Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2∙(+1) + х + 4∙(-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H+12S+6O-24.
Пример 3. Рассчитайте степени окисления всех элементов в молекуле Al(NO3)3.
Решение. Алгоритм остается неизменным. В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1∙(+3) + 3х + 9∙(-2) = 0. Ответ: Al+3(N+5O-23)3. Пример 4. Определите степени окисления всех элементов в (NH4)2SO4.
Решение. Степени окисления водорода и кислорода известны, серы и азота - нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH4+ и SO42-. Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N-3H4+1)2S+6O4-2.
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Когда вещества вступают в химические реакции степени окисления элементов могут изменяться, потому что атомы могут терять или приобретать электрон. Окисление —это процесс, в котором элемент теряет свои электроны. Элемент, который теряет электроны и повышает степень окисления, называется восстановитель.
Если атом отдает свои электроны, то он приобретает положительный заряд: Zn0 -2e = Zn2+ Если отрицательно заряженный ион (заряд -1), например Сl- , отдает 1 электрон, то он становится нейтральным атомом: Cl- - 1e =Cl0
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ - 1e = Fe3+S4+ - 2e = S2+Mn2+ - 4e = Mn6+
Восстановление — это процесс, в котором элемент присоединяет электроны. Элемент, который присоединяет электроны и понижает степень окисления, называется окислителем.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
S0 + 2e = S2-Br0 + 1e = Br-
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
S6+ + 2e = S4+Mn7+ + 5e = Mn2+
или он может превратится в нейтральный атом:
H+ + 1e = H0Al3+ + 3e = Al0.
Окислитель в процессе реакции восстанавливается, восстановитель — окисляется. Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому. Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется — ионная или ковалентная. Поэтому для простоты будем говорить о присоединении или отдаче электронов независимо от типа связи.
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР). Надо научиться расставлять коэффициенты в ОВР методом электронного баланса, потому что обычным подбором это сделать иногда очень трудно.
Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса.
| 1. | Запишите схему реакции (формулы исходных веществ и продуктов реакции). | NH3+CuO→N2+Cu+H2O |
| 2. | Определите и сравните степени окисления элементов до и после реакции. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O |
| 3. | Выбрать (подчеркнуть) элементы, степени, окисления которых изменяются. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O |
| 4. | Выписать эти элементы (простые вещества выписываются с индексами). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O N-3 →N20 Cu+2 →Cu0 |
| 5. | Определить сколько отдал или принял элемент электронов (помнить, что электроны заряжены отрицательно). Количество электронов с участием простых веществ умножается на индекс, а перед ионом выставляется коэффициент, равный индексу. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20 Cu+2 +2℮ →Cu0 |
| 6. | Определите окислитель и восстановитель (окислитель всегда принимает электроны – степень окисления понижается, восстановитель их отдает – степень окисления повышается). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20 восстановитель Cu+2 +2℮ →Cu0 окислитель |
| 7. | Выписать то количество электронов, которое определили. Найти для этих чисел наименьшее кратное. | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 – 6℮ →N20 6 восстановитель 6 Cu+2 +2℮ →Cu0 2 окислитель |
| 8. | Определить коэффициенты (разделив поочередно наименьшее кратное на количество электронов). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20 6 1  восстановитель 6 Cu+2 +2℮ →Cu0 2 3 окислитель восстановитель 6 Cu+2 +2℮ →Cu0 2 3 окислитель |
| 9. | Определить процесс окисления или восстановления (окислитель в процессе реакции восстанавливается, восстановитель окисляется). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+Cu+H2O 2N-3 - 6℮ →N20 6 1 окисление  восстановитель 6 Cu+2 +2℮ →Cu0 2 3 восстановление окислитель восстановитель 6 Cu+2 +2℮ →Cu0 2 3 восстановление окислитель |
| 10. | Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса. Полученные коэффициенты поставить в правой части уравнения (после стрелки) перед теми элементами, напротив которых они стоят в окислительно-восстановительном балансе. Если атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения(в последнем уравнении для кислорода). | -3+1 +2-2 0 0 +1-2 NH3+CuO→N2+3Cu+H2O 2N-3 - 6℮ →N20 6 1 окисление  восстановитель 6 Cu+2 +2℮ →Cu0 2 3 восстановление окислитель Число отданных электронов = Число принятых электронов восстановитель 6 Cu+2 +2℮ →Cu0 2 3 восстановление окислитель Число отданных электронов = Число принятых электронов |
| 11. | Уравнять правую и левую части уравнения (проверить по кислороду, количество атомов кислорода справа и слева должно быть одинаковым). | -3+1 +2-2 0 0 +1-2 2NH3+3CuO→N2+3Cu+H2O 2N-3 - 6℮ →N20 6 1 окисление  восстановитель 6 Cu+2 +2℮ →Cu0 2 3 восстановление окислитель восстановитель 6 Cu+2 +2℮ →Cu0 2 3 восстановление окислитель |
| 12. | Устно проверьте правильность составленного уравнения. | Число атомов каждого химического элемента в правой и левой частях уравнения - одинаково. |
Окислительно-восстановительные реакции очень распространены. С ними связаны не только процессы коррозии, но и брожение, гниение, фотосинтез, процессы обмена веществ, протекающие в живом организме. Их можно наблюдать при сгорании топлива. Окислительно-восстановительные процессы сопровождают круговороты веществ в природе.
Упражнения.
№1 Прочитайте теорию, выпишите в тетрадь важнейшие понятия теории химических связей и выучите их (химическая связь, ковалентная связь, электроотрицательность, ионная связь, π- и σ-связи, полярные связи, металлическая связь, кристаллическая решетка, ОВР, окислитель и окисление, восстановитель и восстановление)
№2 Что такое химическая связь? Какие виды связи бывают?
№3 Какая связь называется ковалентной? Для каких веществ она характерна? Приведите примеры.
№4 Чем похожи и чем отличаются ковалентная полярная и ковалентная неполярная связь? Может ли существовать в одной молекуле разные виды связей?
№5 Какая связь называется ионной? Для каких веществ она характерна? Приведите примеры
№6 Чем похожи и чем отличаются π- и σ –связи? Какая из них более прочная?
№7 Какая химическая связь характерна для металлов? За счет чего она образуется?
№8 Какие виды кристаллических решеток вам известны? Какая из них самая прочная? Какая самая непрочная? Почему?
№9 Какое правило используют для вычисления степени окисления элементов в сложном соединении?
№10 Что такое ОВР? Какую роль играют процессы окисления в организме человека? Напишите реферативное сообщение по этой теме.
№11 Распределите вещества на четыре группы, по видам химической связи:
Na, N2, P2O5, NH3, Fe2O3, CaCl2, Cu, P4, CS2, Na3N, H2O, C, Zn, HF
№12Запишите схему образования молекул, укажите тип связи:
Br2, HCl, H2O, O2, KCl, Na2S
№13 В какой молекуле ковалентная связь более полярная в HF или в HI? Почему?
№14 Какая кристаллическая решетка
а) у нафталина, б) у воды, в) у хрома, г) алмаза, д) у поваренной соли? Ответ поясните.
№15 Определить степень окисления всех элементов входящих в состав соединений: H2, MgCl2, N2O3, Al2(SO4)3, Na2O, Ca, O2, Al2O3, H3P, Ba(NO3)2.
№16. Какой процесс - окисления или восстановления отражает схема? Укажите количество электронов, отданных или присоединенных элементами: а) Cu+2…..=>Cu0; б) Cl-…..=>Cl0;
В) N-3…..=>N+2.
№17. Определите степень окисления хрома в соединениях. В каких из них для хрома характерны свойства только восстановителя? В каких - только окислителя? Ответ поясните.
Cr2O3 , Na2CrO4, CrCl2, CrSO4, K2Cr2O7, Cr
№18.. Определите степени окисления элементов. Обозначьте переход электронов, окислитель и восстановитель. Расставьте коэффициенты в ОВР методом электронного баланса.
а) N2 + H2 → NH3
б) Fe2O3 + CO  Fe + CO2.
Fe + CO2.
в) NO + O2  NO2.
NO2.
г) K2S + HNO3 = KNO3 + S + NO2 + H2O
д) Cu2O + HNO3 = Cu(NO3)2 + NO + H2O
е) KI +KMnO4 + H2SO4 = I2 +MnSO4 + K2SO4 + H2O
Банк тестов по теме 1.3 «Строение вещества»
| вопрос | а | б | в | г |
| 1. ионная связь в соединении | MgCl2 | H3N | CO2 | O3 |
| 2. ковалентная неполярная связь в соединении | CS2 | P4 | NaBr | Al2O3 |
| 3. Ковалентная полярная связь в соединении | H2 | MnCl2 | SiO2 | N2O |
| 4. Ковалентная связь образуется | За счет общих электронных пар | За счет электростатического взаимодействия разноименно заряженных частиц | За счет неспаренных электронов | За счет притяжения ядер атомов |
| 5. ионная связь образуется | За счет общих электронных пар | За счет электростатического взаимодействия разноименно заряженных частиц | За счет неспаренных электронов | За счет притяжения ядер атомов |
| 6. самая полярная связь в соединении | H3N | H2 | H2S | H2O |
| 7. тройная связь между атомами в молекуле | O2 | H2 | N2 | Cl2 |
| 8. двойная связь осуществляется | Двумя электронами | Двумя парами электронов | Между двумя атомами | Между двумя молекулами |
| 9. самая прочная связь | ионная | Ковалентная полярная | Ковалентная неполярная | водородная |
| 10. самая слабая связь | ионная | Ковалентная полярная | Ковалентная неполярная | водородная |
| 11. в соединении NO2 связь | ионная | Ковалентная полярная | Ковалентная неполярная | водородная |
| 12. в соединении MnCl2 кристаллическая решетка | Ионная | молекулярная | атомная | металлическая |
| 13. в соединении СО2 кристаллическая решетка | Ионная | молекулярная | атомная | металлическая |
| 14. степень окисления марганца в MnO2 | +2 | +4 | -7 | |
| 15. Определите степень окисления азота в соединении KNO2 | +1 | +3 | -3 | |
| 16. В каком соединении сера имеет минимальную степень окисления | S | Na2SO4 | MgS | H2SO3 |
| 17. HClO→HCl | Хлор окислился | Хлор восстановился | Хлор не изменял степень окисления | Это не ОВР |
| 18. N+5→ N-3 | Азот отдал 5е | Азот отдал 8е | Азот принял 8е | Азот принял 2е |
| 19. коэффициент перед окислителем равен N2 + H2 → NH3 | ||||
| 20. в ОВР восстановителем является PbS + O2 → PbO + SO2 | Pb+2 | S-2 | О0 | S+4 |
