Химические свойства сопряженных алкадиенов
Реакции электрофильного присоединения и полимеризации сопряженных алкадиенов происходят, как правило, по положениям 1 и 4:
CH2=CH–CH=CH2 + Br2 ® CH2Br–CH=CH–CH2Br
CH2Br–CH=CH–CH2Br + Br2 ® CH2Br–CHBr–CHBr–CH2Br
CH2=CH–CH=CH2 + 2Br2 ® CH2Br–CHBr–CHBr–CH2Br;
CH2=CH–CH=CH2 + HBr ® CH3–CH=CH–CH2Br
CH3–CH=CH–CH2Br + HBr ® CH3–CHBr–CH2-–CH2Br
CH2=CH–CH=CH2 + 2HBr ® CH3–CHBr–CH2-–CH2Br.
Гидратация не характерна для сопряженных алкадиенов, так как при нагревании в присутствии кислот (условие гидратации алкенов) происходит их полимеризация, которая приводит к образованию каучуков:
nCH2=CH–CH=CH2 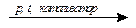 (–CH2–CH=CH–CH2–)n
(–CH2–CH=CH–CH2–)n
бутадиен-1,3 бутадиеновый (дивиниловый)
каучук (синтетический)
nCH2=C(СН3)–CH=CH2 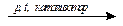 (–CH2–C(СH3)=CH–CH2–)n
(–CH2–C(СH3)=CH–CH2–)n
2-метилбутадиен-1,3 (изопрен) изопреновый каучук (природный)
nCH2=CСl–CH=CH2 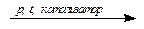 (–CH2–CCl=CH–CH2–)n
(–CH2–CCl=CH–CH2–)n
2-хлорбутадиен-1,3 хлоропреновый каучук
В полимерных молекулах каучуков сохраняются двойные связи, атомы углерода при которых имеют разные заместители, поэтому для них характерна геометрическая изомерия:
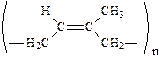 | 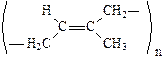 |
| цис-изомер, получается при природной полимеризации изопрена, эластичен. | транс-изомер, получается при искусственной полимеризации изопрена, малоэластичен (гуттаперча). |
Синтетический каучук содержит как цис-, так и транс-изомеры (стереонерегулярен).
Для уменьшения пластичности, повышения прочности, износоустойчивости и стойкости к агрессивным средам каучук подвергают вулканизации (нагревают с серой без доступа воздуха). Сера в парах существует в виде двухатомных молекул. Двойные связи каучука при нагревании частично разрушаются, и отдельные полимерные молекулы «сшиваются» дисульфидными мостиками, образуя пространственный полимер – резину. Чем больше двойных связей взаимодействует с серой, тем меньше эластичность и больше прочность резины.
Получение алкадиенов
1. Дегидрирование алканов и алкенов:
С4Н10 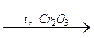 Н2 + С4Н8;
Н2 + С4Н8;
С4Н8 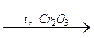 Н2 + С4Н6.
Н2 + С4Н6.
2. Дегидратация и дегидрирование этанола (реакция Лебедева):
2C2H5OH  CH2=CH–CH=CH2 + 2H2O + H2.
CH2=CH–CH=CH2 + 2H2O + H2.
3. Получение хлоропрена из ацетилена:
2СHºCH ® СH2=CH–СºCH;
СH2=CH–СºCH + HCl ® СH2=CH–СCl=CH2.
Диеновые углеводороды в природе
Вприроде широко распространены полимерные производные изопрена: терпены и терпеноиды.
Терпе́ны –класс углеводородов, природных органических веществ, вторичных растительных метаболитов. Они представляют собой продукты ди-, тетра- или гексамеризации изопрена. В больших количествах терпены содержатся в растениях семейства хвойные, во многих эфирных маслах. Терпены — основной компонент смол и бальзамов, так, скипидар получают из живицы. Название «Терпены» происходит от лат. «Oleum Terebinthinae» — скипидар.
Терпеноиды – производные терпенов, содержащие функциональные группы. Терпеноиды являются активными участниками обменных процессов, протекающих в растениях. Некоторые терпеноиды регулируют активность генов растений, участвуют в фотохимических реакциях. Углеродные цепи ряда терпеноидов являются ключевыми промежуточными продуктами в биосинтезе стероидных гормонов, холестерина, ферментов, витаминов Д, Е, К, желчных кислот. Растительные терпеноиды имеют широкий спектр биологического действия и поэтому представляют интерес для поиска новых лекарственных препаратов.
Так как изопрен (2-метилбутадиен-1,3) – несимметричная молекула, то реакции ди- и полимеризации может происходить разными способами:

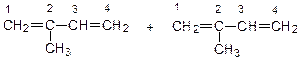
1.Голова – хвост:
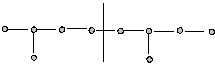
2. Голова – голова:
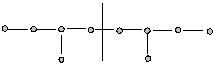
3. Хвост – хвост:
Терпеновые группы могут формировать цепочки и циклы. В зависимости от характера углеродного скелета терпены и терпеноиды делят на следующие группы.
а). Алифатические (с открытой цепью):
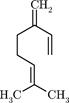 | Мирцен (монотерпен). Содержится в эфирных маслах (особенно в масле хмеля - до 50%) и в скипидаре. Особенно много мирцена содержится в укропе, кориандре, багульнике. |
б). Моноциклические:
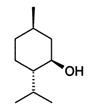 | Ментол (монотерпеноид), важный вторичный метаболит растений. Обладает слабыми местноанестизирующими свойствами, стимулирует холодовые рецепторы кожи и слизистых, слабый антисептик. Широко используется в медицине и пищевкусовой промышленности в качестве нейтрализатора химически-активных молекул растительных наркотических средств. |
в). Бициклические:
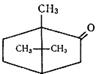 | Камфора (монотерпеноид), входит в состав многих эфирных масел. Натуральную камфору получают из древесины или смолы камфорного лавра. Камфору используют в медицине и ароматерапии. |
В качестве примеров более сложных производных изопрена можно привести каротиноиды:
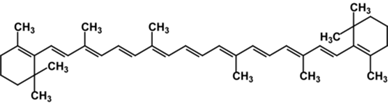
b-каротин,
желто-оранжевый растительный пигмент, один из 600 природных каротиноидов. Служит предшественником витамина А (ретинола)
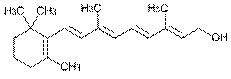
К изопреноидам относятся также стероиды – вещества животного или реже растительного происхождения, обладающие высокой биологической активностью, например:
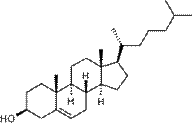 | 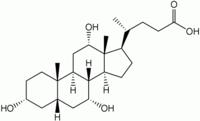 |
| холестерин (обеспечивает стабильность клеточных мембран) | холевая кислота (из группы желчных кислот) |
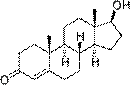 | 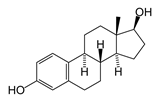 |
| тестостеро́н (основной мужской половой гормон) | эстрадиол (основной женский половой гормон) |
АЛКИНЫ
Углеводороды класса алкинов отвечают общей формуле CnH2n–2 и характеризуются наличием тройной связи в составе молекулы. Атомы углерода при тройной связи имеют sp-тип гибридизации. Две гибридные орбитали (по одной от каждого атома углерода), перекрываясь, образуют s-связь (осевое перекрывание). Оставшиеся негибридные р-орбитали атомов углерода располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании p-связи (боковое перекрывание).
Физические свойства. Алкины, содержащие от двух до четырех атомов углерода – бесцветные газы без запаха, остальные – жидкие и твердые вещества. Температуры плавления и кипения увеличиваются с увеличением числа атомов углерода в цепи.
Химические свойства. Основными типами химических реакций алкинов являются реакции электрофильного присоединения, окисления и полимеризации.
Реакции присоединения.
1. Гидрирование: СHºCH + 2H2 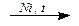 CH3–CH3
CH3–CH3
2. Галогенирование: CHºCH + Br2 ® CHBr=CHBr;
CHBr=CHBr + Br2 ® CHBr2–CHBr2
или CHºCH + 2Br2 ® CHBr2–CHBr2
(обесцвечивание бромной воды – качественная реакция на соединения с кратными – двойными и тройными) связями).
3. Гидрогалогенирование: CHºCH + НBr ® CH2=CHBr;
CH3–СºСН + HBr ® СH3–CBr=CH2;
CH3–CBr=CH2 + HBr ® CH3–CBr2–CH3
(присоединение происходит по правилу Марковникова).
4. Гидратация (присоединение воды в присутствии солей ртути – реакция Кучерова):
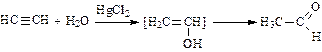
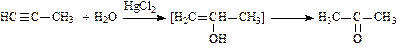
(при гидратации ацетилена получают этаналь (уксусный альдегид); при гидратации гомологов ацетилена получают кетоны).
Реакции окисления
1. Горение ацетилена: 2С2Н2 + О2 (недост.) ® 4С + 2Н2О
(в недостатке кислорода ацетилен горит коптящим пламенем);
2С2Н2 + 5О2 (недост.) ® 4СО2 + 2Н2О + 2700 кДж
(при горении ацетилена в токе кислорода развивается температура до 3000°С, что используется при ацетиленовой сварке).
2. Окисление алкинов перманганатом калия (алкины окисляются перманганатом калия труднее, чем алкены):
3СНºСН + 8KMnO4 ® 2K2C2O4 + 8MnO2 + 2KOH + 2H2O
(окисление ацетилена в нейтральной среде);
5CH3–CºCH + 8KMnO4 + 12H2SO4 ®
® 5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O
(окисление алкинов в кислой среде).
Реакции полимеризации
Димеризация: 2СНºСН 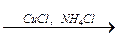 СН2=СН–CºCH (винилацетилен).
СН2=СН–CºCH (винилацетилен).
Тримеризация (реакция Зелинского):
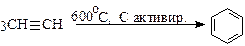 (бензол);
(бензол);
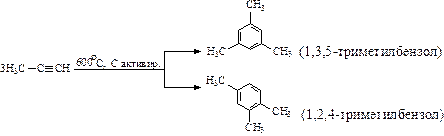
Кислотные свойства алкинов
Алкины с концевыми тройными связями обладают кислотными свойствами – происходит замещение атомов водорода у sp-гибридизованного атома углерода на металл:
СНºСН + 2[Ag(NH3)2]OH ® Ag–CºC–Ag ¯ + 4NH3 + 2H2O;
ацетиленид серебра
CH3–CºCH + CuCl + NH4OH ® CH3–CºC–Cu ¯ + 2NH3 + H2O;
CH3–CºC–CH3 + Ag2O (NH3) ¹
(тройная связь не является концевой);
CH3–CºCH + NaH ® CH3–CºC–Na + H2;
CH3–CºC–Na + H2O ® CH3–CºCH + NaOH
(гидролиз ацетиленидов);
CH3–CºC–Na + СH3–CH2I ® NaI + CH3–CºC–CH2–CH3
(синтез гомологов ацетилена).
Получение алкинов.
1. Высокотемпературный крекинг метана и его ближайших гомологов: 2СН4 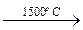 С2Н2 + 3Н2;
С2Н2 + 3Н2;
С2Н6 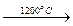 С2Н2 + 2Н2; 2С3Н8
С2Н2 + 2Н2; 2С3Н8 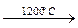 3С2Н2 + 5Н2.
3С2Н2 + 5Н2.
2. Дегидрогалогенирование дигалогеноалканов:
CH2Br–CH2Br + 2KOH 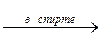 CHºCH + 2KBr + 2H2O.
CHºCH + 2KBr + 2H2O.
3. Гидролиз карбида кальция:
СаС2 + 2Н2О ® Са(ОН)2 + CHºCH.
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
Особыми свойствами обладают циклические соединения с чередующимися двойными и простыми связями, в которых электронная плотность выровнена между атомами цикла. Они носят название ароматических соединений или аренов. Простейшим представителем аренов является бензол:
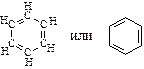
Общая формула ароматических соединений – гомологов бензола – CnH2n–6:
| С6Н6 | С7Н8 | ||||
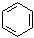 | 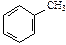 | ||||
| бензол | метилбензол (толуол) | ||||
| С8Н10 | |||||
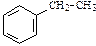 | 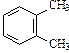 | 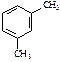 | 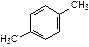 | ||
| этилбензол | 1,2-диметилбензол (орто-ксилол) | 1,3-диметилбензол (мета-ксилол) | 1,4-диметилбензол (пара-ксилол) | ||
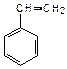 | 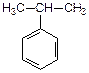 | ||||
| винилбензол (стирол) | изопропилбензол (кумол) | ||||
Атомы углерода в молекуле бензола находятся в состоянии sp2-гибридизации. Гибридные орбитали образуют три s-связи с двумя атомами углерода и одним атомом водорода, а негибридная орбиталь – p-связь. Углы между связями равны 120°, поэтому бензольное кольцо плоское. Все p-связи в бензольном кольце объединены в единое p-электронное облако (сопряженные связи): 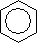 .
.
В 1932 г. американский ученый Э. Хюккель сформулировал правило: к ароматическим системам относятся молекулы с плоским строением, содержащие (4n+2) электронов, находящихся в состоянии сопряжения (n = 0, 1, 2, и т.д.).
Исходя из правила Хюккеля, бензол – ароматическая система: три двойные связи, 6 p-электронов, правило выполняется для n = 1 (4×1+2=6).
В то же время циклооктатетраен 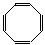 не является ароматической системой, так как имеет 8 p-электронов (правило Хюккеля не выполняется ни для одного целого значения n).
не является ароматической системой, так как имеет 8 p-электронов (правило Хюккеля не выполняется ни для одного целого значения n).
В конденсированных ароматических соединениях два соседних "срощенных" цикла имеют два общих атома. При этом возможны три типа сочленения циклов.
1. Линейное:
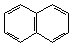 | 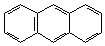 |
| нафталин | антрацен |
2. Ангулярное (угловое):
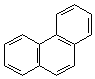 | 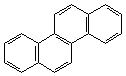 |
| фенантрен | хризен |
3. Пери-сочленение (наличие атомов углерода, общих для трех циклов):
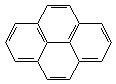 | 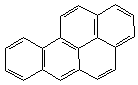 |
| пирен | бензпирен |
В случае пери-сочленения общее число p-электронов не отвечает правилу Хюккеля (4n+2) и, следовательно, соответствующие соединения не должны относиться к ароматическим. Однако в них можно выделить отдельные составляющие их моноциклические ароматические соединения (обычно с шестью p-электронами) или рассматривать p-электронные оболочки по периметру полициклической системы; если они включают 10, 14, 18 и т.д. p-электронов, то в соответствии с правилом Хюккеля их относят к ароматическим.
Химические свойства. Сопряженная p-электронная система бензола и его гомологов – энергетически выгодное состояние, поэтому ее разрушение протекает с большим трудом. Реакции присоединения для аренов малохарактерны, чаще встречаются реакции электрофильного замещения (SE). Они идут в присутствии катализаторов: Fe, соли трехвалентных металлов – кислоты Льюиса.
Кислоты Льюиса -частицы, которые способны к образованию донорно-акцепторных связей, как накопители электронных пар – акцепторы: AlCl3 + Cl– → [AlCl4]–
Химические свойства бензола
1. Галогенирование:
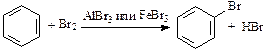
(бензол не обесцвечивает бромную воду).
2. Нитрование:
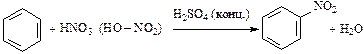 .
.
3. Алкилирование:
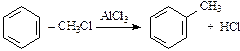 ;
;
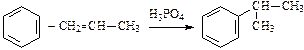 ;
;
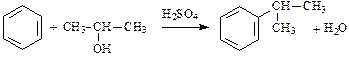 .
.
4. Реакции присоединения:
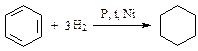 (циклогексан);
(циклогексан);
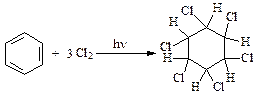 (гексахлорциклогексан).
(гексахлорциклогексан).
5. Окисление: 12С6Н6 + 15О2 ® 12СО2 + 6Н2О (горение). Бензол не окисляется растворами перманганата калия.
Химические свойства гомологов бензола
Заместители в бензольном кольце оказывают ориентирующее действие на процесс вхождения второго заместителя: направляют его в строго определенное положение.
Алкильные заместители в бензольном кольце незначительно увеличивают активность гомологов бензола и перераспределяют p-электронную плотность таким образом, что предпочтительным становится замещение в положения 2, 4 и 6 относительно алкильного заместителя (орто- и пара-замещение):
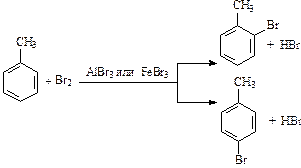
Нитрование толуола приводит к образованию тринитропроизводного:
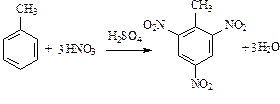 (тринитротолуол).
(тринитротолуол).
При облучении ультрафиолетовым светом гомологи бензола вступают в реакцию замещения по боковой цепи, причем наибольшую активность имеют атомы углерода, непосредственно соединенные с бензольным кольцом:
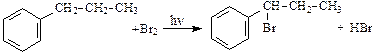 .
.
Гомологи бензола горят с образованием углекислого газа и воды, а также окисляются растворами перманганата калия по боковой цепи с образованием бензойной кислоты или ее солей:
С6Н5СН3 + 9О2 ® 7СО2 + 4Н2О (горение);
5С6Н5CH3 + 6KMnO4 + 9H2SO4 ®
5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O;
С6Н5CH3 + 2KMnO4  C6H5COOK + 2MnO2¯ + KOH + H2O;
C6H5COOK + 2MnO2¯ + KOH + H2O;
5С6Н5CH2CH3 + 12KMnO4 + 18H2SO4 ®
® 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O;
С6Н5CH2CH3 + 4KMnO4 
C6H5COOK + K2CO3 + 4MnO2¯ + KOH + 2H2O.
Химические свойства производных бензола
Производные бензола содержат функциональные группы, соединенные с бензольным кольцом. За счет взаимного влияния групп атомов и функциональных групп происходит перераспределение p-электронной плотности и, как результат, изменение активности бензольного кольца в реакциях электрофильного замещения. По механизму воздействия функциональные группы делятся на 2 типа:
1. Заместители I рода (NH2- и OH-группы) увеличивают p-электронную плотность в цикле за счет взаимодействия (сопряжения) неподеленных пар электронов азота и кислорода с сопряженной системой двойных связей цикла:
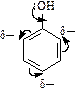 | В результате отталкивания сопряженной p-электронной системы бензола от пары электронов кислорода или азота происходит увеличение отрицательного заряда в кольце и его сосредоточение в орто- и пара- положениях (индуктивный эффект). Это приводит к |
увеличению активности в реакциях замещения, они идут без катализатора сразу по трем положениям. В частности, фенол и анилин обесцвечивают бромную воду:
фенол 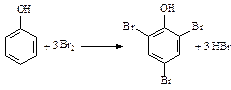
анилин 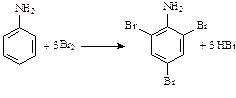
Ориентирующая сила заместителей I рода убывает в последовательности:
-NH2 > -OH > -OCH3 > -CH3 (алкил) > -F > -I > -Br > ³ -Cl
2. Заместители II рода (NO2-, COOH- и другие группы) содержат атомы с большими электроотрицательностями, которые оттягивают на себя p-электронную плотность цикла:
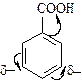 | В результате общий отрицательный заряд в кольце уменьшается и сосредотачивается в мета-положениях (положениях 3 и 5 бензольного кольца). Активность в реакциях замещения меньше, чем в случае незамещенного бензола: |
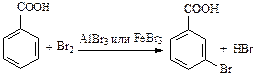
(бензойная кислота не обесцвечивает бромную воду).
Уменьшение ориентирующей силы заместителей II рода происходит в последовательности:
-COOR > -COOH > C=O (кетон) > CHO (альдегид) > -SO3H > -NO2
При наличии двух заместителей разного рода место замещения в бензольном кольце определяет заместитель I рода, так как он активирует бензольное кольцо. Если оба ориентанта одного рода, то место замещения определяет более сильный заместитель.
Особенности химических свойств конденсированных циклов
Взаимное влияние двух конденсированных циклов (например, в нафталине) приводит к повышению активности атомов водорода в a-положении:
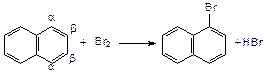
Реакции замещения протекают легче, чем для бензола. b-Изомеры образуются при повышенных температурах (> 100оС).
Окисление конденсированных циклов также идет значительно легче:
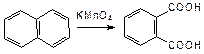
Легкостью окисления конденсированных циклов и их способностью к различным превращениям в организме объясняются канцерогенные свойства большинства конденсированных аренов.
