Химические особенности сопряженных диенов.
1. 1,2- и 1,4-присоединение реагентов.
Гидрирование и галогенирование. Двойные связи дивинила реагируют не каждая сама по себе, а как единая p-система; атака мезомерного катиона нуклеофилом Вr- приводит к продуктам 1,2- и 1,4-присоединения, поскольку именно второй и четвертый атомы углерода сопряженной системы двойных связей несут в этом катионе положительный заряд:
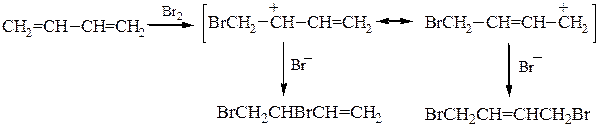
Присоединение второй молекулы реагента дает один насыщенный продукт – 1,2,3,4-тетрабромбутан.
Аналогично, ступенчатое гидрирование бутадиена-1,3 протекает через образование бутена-1 (продукт 1,2-присоединения) и бутена-2 (продукт 1,4-присоединения), а полное гидрирование приводит к бутану.
Взаимодействие бутадиена-1,3 с хлороводородом происходит по механизму электрофильного присоединения (АЕ). При разрыве единой p-электронной системы сопряженного диена могут образовываться два карбкатиона:
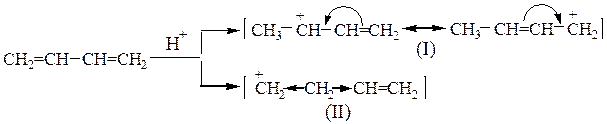
Катион (I) представляет собой мезомерный катион, так как p-электроны двойной связи взаимодействуют с образующимся положительным центром, в результате чего происходит перераспределение электронной плотности:
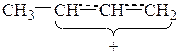
Образовавшийся ион более устойчив, чем ион (II), в котором л-связь непосредственно не участвует во взаимодействии с карбкатионным центром и, кроме того, индуктивный эффект соседнего насыщенного атома углерода уменьшен под влиянием ненасыщенной винильной группы. Поэтому преимущественно образуется карбкатион (I), который на втором этапе реакции может связаться с хлорид-анионом через один из двух атомов углерода (центральный атом аллильного катиона не может образовывать новую связь):
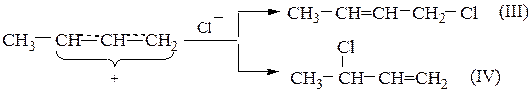
Соотношение количеств изомеров (III) и (IV) зависит от условий проведения процесса. При обычных условиях преобладает продукт (III). Согласно общему механизму реакций присоединения анион хлора должен атаковать карбкатионный центр с противоположной стороны по отношению к той, где образовалась связь С-Н, поэтому более доступным для атаки оказывается самый удаленный концевой атом углерода аллильного иона.
2-метилбутадиена-1,3 гидрохлорирование эквимолярным количеством HCl
преимущественно дает 4-хлор-2-метилбутен-2.
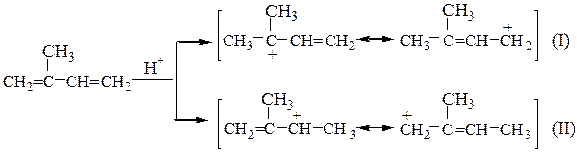
Гибридный катион (I) имеет положительный заряд частично на третичном атоме углерода; в гибридном катионе (II) положительный заряд распределен между вторичным и первичным С-атомами. Таким образом гибрид (I) более стабилен и будет промежуточно образующимся в реакции карбкатионом. 1,4-Присоединение хлороводорода к изопрену дает
Электрофильное и радикальное присоединение к сопряженным диенам протекает легче, чем у алкенов. Это объясняется тем, что из диенов легче образуются карбкатионы или радикалы аллильного типа, которые стабильнее насыщенных карбкатионов или радикалов.
Диеновая конденсация (реакция Дильса-Альдера).При наличии у диенов цис-сопряженной системы двойных связей происходит их взаимодействие с непредельными соединениями (диенофилами) по типу 1,4-циклоприсоеди-нения, причем образующиеся с высокими выходами вещества (аддукты) содержат шестичленный цикл.
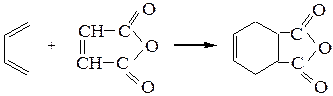
бутадиен-1,3 малеиновый аддукт
ангидрид
(диенофил)
Полимеризация и сополимеризация. Сопряженные диены более склонны к полимеризации, чем алкены. В зависимости от строения исходного сопряженного диена, условий реакции, катализатора возможно образование полимерной цепи как за счет 1,4-, так и 1,2-присоединения. Практическое значение имеют полимеры, полученные в результате 1,4-присоединения.
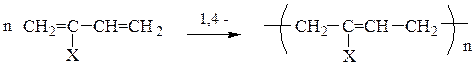
полимер
Натуральный каучук является полимером 2-метилбутадиена-1,3 (Х = СН3) и по строению он представляет собой цис-полиизопрен.
При сшивании линейных макромолекул каучука, как правило, сульфидными мостиками, он превращается в резину, теряет пластичность и приобретает упругость. Процесс превращения каучука в резину называется вулканизацией:
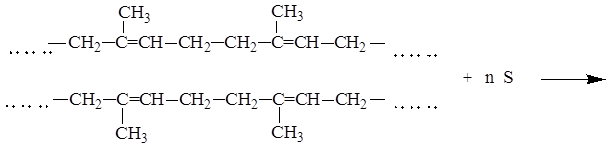
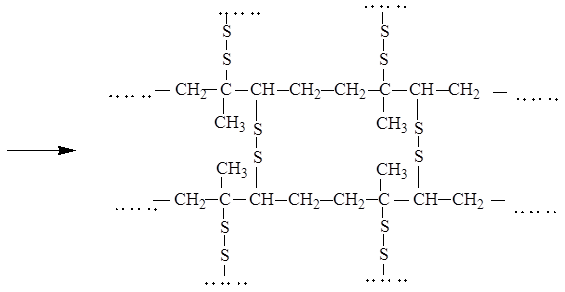
В настоящее время налажено производство различных видов каучуков, основанные на сополимеризации сопряженных диенов с прочими мономерами:
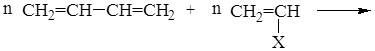
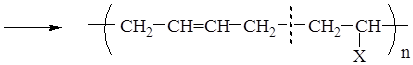
сополимер (например: Х = С6Н5 – бутадиен-стирольный каучук;
CN – бутадиен-нитрильный каучук и др.)
Контрольные вопросы к главе 3 «Диеновые углеводороды»
№ 1. Почему в случае присоединения хлороводорода к бутадиену-1,3 образуется смесь 3-хлорбутена-1 и 1-хлорбутена-2, в которой преобладает второе из названных соединений.
№ 2. При 1,4-присоединении хлороводорода к 2-метилбутадиену-1,3 (изопрену) в качестве основного продукта образуется 1-хлор-3-метилбутен-2, а не 1-хлор-2-метилбутен-2. Почему ?
№ 3. Какой из диенов – бутадиен-1,3 , изопрен (2-метилбутадиен-1,3) или пиперилен (пентадиен-1,3) при взаимодействии с 1 моль бромоводорода при 25 0С дает только один продукт?
№ 4. Изобразите конфигурации цепей полимеров, полученных из бута-диена-1,3 в результате: (а) цис-1,4-присоединения; (б) транс-1,4-присоединения.
Что образуется в результате озонолиза полученных полимерных продуктов?
№ 5. При термической полимеризации бутадиена-1,3 в качестве побочного продукта образуется циклический димер, не склонный к дальнейшей полимеризации. Это вещество при гидрировании дает этилциклогексан; способно присоединять 2 моль брома; в результате деструктивного окисления образует 3-карбоксигександиовую кислоту. Какое строение имеет молекула димера бутадиена-1,3?
№ 6.Напишите уравнения реакций диеновой конденсации: (а) бутадиена-1,3 с тетрацианоэтиленом; (б)1-винилциклопентена с акролеином СH2=CH-CN; (в) 2-метилпентадиена-2,4 с малеиновым ангидридом; (г) 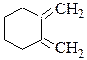 c 1,2-диметиленциклогексана с акролеином (д)циклогексадиена-1,3 с диметиловым эфиром ацетилендикарбоновой кислоты.
c 1,2-диметиленциклогексана с акролеином (д)циклогексадиена-1,3 с диметиловым эфиром ацетилендикарбоновой кислоты.
№ 7. Из каких реагентов можно получить следующие соединения по реакции Дильса—Альдера: 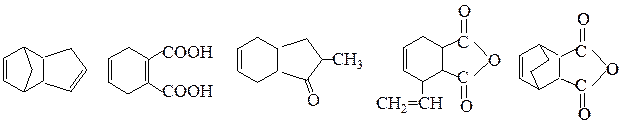 № 8.Проведите озонолиз следующих соединений: (а)2-метилгептадиена-2,5; (б) 2,3-диметилциклогексадиена-1,3;
№ 8.Проведите озонолиз следующих соединений: (а)2-метилгептадиена-2,5; (б) 2,3-диметилциклогексадиена-1,3;
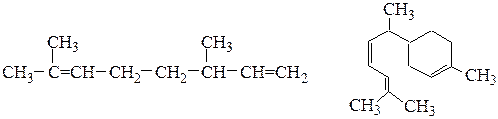
(в) мирцена (выделен из листьев лавра) (г) цингиберена
№ 9.Установите строение углеводородаС11Н20, если при окисление его хромовой смесью приводит к смеси бутанона-2, бутандиовой кислоты и пропионовой кислоты.
№ 10. Витамин D2 представляет собой непредельный спирт С28Н44О, в котором нет тройных связей. При каталитическом гидрировании он дает соединение С28Н52О. Сколько двойных связей содержит молекула витамина D2 ?
АЛКИНЫ
Определение.Алкины – ненасыщенные углеводороды, содержащие тройную связь и образующие гомологический ряд общей формулы СnH2n-2.
Изомерия.Обусловлена как разветвлением углеродного скелета (а), так и положением тройной связи (б); межклассовая изомерия с диенами (в).
CH3
|
(а) НC≡C–CH2–CH2–CH3 и НC≡C–CH–CH3
пентин-1 2-метилпропен-1
(б) НC≡C–CH2–CH2–CH3 и CH3–C≡C–CH2–CH3
пентин-1 пентин-2
(в) НC≡C–CH2–CH2–CH3 и CH2=CН–CН=CH–CH3
пентин-1 пентадиен-1,3
Геометрическая изомерия для алкинов не существует, т.к. атомы углерода при тройной связи и соседние углеродные атомы лежат на одной прямой.
Номенклатура.Простейший представитель имеет тривиальное название – ацетилен. По рациональной номенклатуре алкины рассматривают как замещен-ный ацетилен.По номенклатуре IUPAC название алкина происходит от названия соответствующего алкана заменой суффикса «-ан» на «-ин». Положение тройной связи обозначают цифрой, указывающей наименьший номер атома углерода главной цепи, при котором она находится.
СH3–CH2-CºC-CH2–CH2–CH2–CH3 этилбутилацетилен (рац.); октин-3 (IUPAC)
Строение.Атом углерода в ацетиленовых углеводородах находится в sp-гибридном состоянии. Две гибридные sp-орбитали каждого атома углерода (состоящие из одной s- и одной p-орбиталей) участвуют в образовании двух σ-связей: c cоседними атомами углерода и водорода. Две σ-связи расположены в одной плоскости под углом 1800 по отношению друг к другу. При этом у каждого атома углерода остается по два свободных негибридизованных р-электрона. Негибридизованные p-орбитали перекрываются в плоскостях, перпендикулярных плоскости σ-связи. Связи, образованные за счет такого перекрывания, являются π-связями. Таким образом, тройную связь рассматривают как состоящую из одной σ-связи и двух π-связей.
Физические свойства.
В гомологическом ряду алкинов с возрастанием длины углеродной цепи так же, как для алканов и алкенов, наблюдается закономерное изменение физических свойств. Ацетилен и пропин – газы, другие гомологи – жидкости, а высшие алкины – твердые вещества. Температуры их кипения, плавления и плотности несколько выше, чем у алканов и алкенов с одинаковым количеством углеродных атомов в молекуле (см. таблицу 5 ).
Способы получения.
1. Ацетилен получают действие воды на карбид кальция. Карбид кальция образуется при нагревании смеси жженой извести и кокса при 2500 0С.
СаО + 3 С ¾® CaC2 + CO CaC2 + 2 H2O ¾® Ca(OH)2 + HC≡CH
Ацетилен также образуется в результате пиролиза или электрокрекинга природного метана при высоких температурах:
2 CH4 ¾® HC≡CH + 3 H2
Таблица 5. Физические свойства алкинов.
| Название | Формула | Т пл. 0С | Т.кип. 0 С | ρ, г· см-3 |
| Ацетилен Пропин Бутин-1 Бутин-2 Пентин-1 Пентин-2 3-метилбутин-1 Гексин-1 Гептин-1 Октин-1 Нонин-1 Децин-1 Гексин-2 Гексин-3 3,3-диметилбутин-1 Октин-4 Децин-5 Октадецин-1 Фенилацетилен Дифенилацетилен | НС≡СН НС≡С–СН3 НС≡С–СН2–СН3 СН3–С≡С–СН3 НС≡С–(СН2)2–СН3 СН3–С≡С–СН2–СН3 (СН3)2СН–С≡СН НС≡С–(СН2)3–СН3 НС≡С–(СН2)4–СН3 НС≡С–(СН2)5–СН3 НС≡С–(СН2)6–СН3 НС≡С–(СН2)7–СН3 СН3–С≡С–(СН2)2–СН3 СН3–СН2–С≡С–СН2–СН3 (СН3)3С–С≡СН СН3(СН2)2С≡С(СН2)2СН3 СН3(СН2)3С≡С(СН2)3СН3 НС≡С–(СН2)15–СН3 НС≡С–С6Н5 С6Н5–С≡С–С6Н5 | - 82 - 105 - 130 ─ - 95 - 101 ─ - 124 - 80 - 70 - 65 - 36 - 92 - 51 - 81 + 27 - 45 + 62,5 | - 83,5 - 23 - 8,5 29,5 | 0,62 0,6785 0,668 0,688 0,688 0,713 0,685 0,719 0,733 0,747 0,763 0,770 0,730 0,725 0,669 0,748 0,760 0,802 0,930 |
