Бірінші ретті қайтымсыз реакцияның теңдеуін былай жазайық:А реакция өнімдері
Мысалға:2N2O5 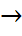 O2+2N2O4
O2+2N2O4
Ацетонның айырылу реакциясы CH3COCH3(газ) 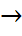 CO+C2H4+H2
CO+C2H4+H2
Кез келген t уақыт уақыи мезгіліндегі реакцияның жылдамдығы ( 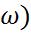 төмендегідей өрнектеледі:
төмендегідей өрнектеледі: 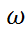 =-d(a-x)/dt=dx/dt=k(a-x)
=-d(a-x)/dt=dx/dt=k(a-x)
Бірінші ретті қайтымсыз реакцияларға мысал ретінде гексафенилэтанның бос радикалдарға ыдырауын келтіруге болады: (C6H5)3C-C(C6H5)3 (C6H5)3C
Екінші ретті қайтымсыз реакциялар практикада жиі кездеседі.Бұл реакцияларға мысал ретінде күрделі эфирдің сілтімен әрекеттесуін мысалға келтіруге болады:
CH3COOC2H5+NaOH 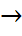 CH3COONa+C2H5OH
CH3COONa+C2H5OH
Азот диоксидінің айырылу реакциясы да екінші ретті қайтымсыз реакциялар да жатады:2NO2 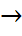 2NO+O2 Екінші ретті қайтымсыз реакцияның теңдеуін былай жазамыз:А+В
2NO+O2 Екінші ретті қайтымсыз реакцияның теңдеуін былай жазамыз:А+В 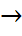 реакция өнімдері.
реакция өнімдері.
Шінші ретті қайтымсыз реакциялар.Үшінші реттілікпен өтетін реакцияларды қарастыруды ең қарапайым жағдайдан бастайық Яғни эквивалентті мөлшерде әрекеттесетін үш заттың концентрациялары бірдей болсын.
А+В+С 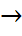 реакция өнімдері.
реакция өнімдері.
Заттардың бастапқы концентрациялары 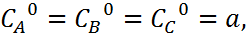 ал реакция басталғаннан t уақыт өткеннен кейін концентрациялары (a-x) дейік.Бұл жағдайда реакция жылдамдығы мына түрге жазылады:
ал реакция басталғаннан t уақыт өткеннен кейін концентрациялары (a-x) дейік.Бұл жағдайда реакция жылдамдығы мына түрге жазылады:
W=-d(a-x)/dt=dx/dt=k(a-x)3
Мұндай реакция ларға мысал ретінде мына реакциялар жатады:2NO2+Cl2=2NOCl
2NO+O2=2NO2
Енді реакцияласушы үш заттың бастапқы концентрациялары әр түрлі болып,онда реакция жылдамдығының дифференциалдық теңдеуі былпй жазылады:
dx/dt=k(a-x)(b-x)(c-x)
Бұл теңдеудің айнымалы шамаларын айырып жазсақ:
Dx/ 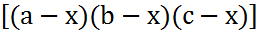 =kdt
=kdt
Химиялық реакция жылдамдығының темпеатураға тәуелділігі. Активтену энергиясы, оның физикалық мағанасы және оны есептеу жолдары. Химиялық реакция деп бір немесе бірнеше заттың химиялық өзгеріске ұшырап бір немесе бірнеше жаңа заттарға айналуын айтамыз.Көп жағдайларда химиялық реакция нәтижесінде бастапқы заттар молекулаларынан реакция өнімі түзілуі тікелей бір сатымен бірнеше сатылармен өтеді.Химиялық реакция сатыларының жыйынтығын реакцияның механизмі д.а.Реакцияның термодинамикалық қасиеттері-энтальпия,энтропия,Гиббс энергиясының өзгерістері реакцияның жүру жолдарына байланысты емес.Бір ғана фазада өтетін химиялық реакцияны гомогенді реакция дейді.Екі немесе одан да көп фазалардың фазааралық шекарасында өтетін реакцияны гетерогенді реакция деп атайды.Кейбір сатылары гомогенді жағдайда,ал басқалары гетерогенді жағдайда өтетін күрделі химиялық реакцияны гомогенді-гетерогенді реакция д.а.Мысалы ерітіндіде өтетін гомогенді реакцияларға жатады,ал гетерогенді реакциялар ретінде қатты катализатор бетінде жүретін катализдік процестерді жатқызуға болады.
Бастапқы алынға заттар мен реакция нәтижесінде шыққан өнімдердің бір фазада немесе әр түрлі фазада болуына байланысты химиялық просестерді гомофазалы және гетерофазалы деп бөлеміз.
Геторегенді-гомофазалы процеске мысал ретінде:
С2H4+H2  C2H6
C2H6
CaCO3+2HCl  CaCl2+CO2
CaCl2+CO2  +H2O
+H2O
