Задачи для самостоятельного решения. 4.1. Найти молярную концентрацию ионов H+ в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет:
4.1. Найти молярную концентрацию ионов H+ в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет:
а) 10-4; б) 3,2∙10-6; в) 7,4∙10-11.
4.2. Найти молярную концентрацию ионов OH– в водных растворах, в которых концентрация ионов водорода (в моль/л) равна:
а) 10-3; б) 6,5∙10-8; в) 1,4∙10-12.
4.3. Вычислить рН растворов, в которых концентрация ионов H+ (в моль/л) равна: а) 2∙10-7; б) 8,1∙10-3; в) 2,7∙10-10.
4.4. Вычислить рН растворов, в которых концентрация ионов OH– (в моль/л) равна: а) 4,6∙10-4; б) 5∙10-6; в) 9,3∙10-9.
4.5. Вычислить рН 0,01 н. раствора уксусной кислоты, в котором степень диссоциации кислоты равна 0,042.
4.6. Определить рН раствора, в 1 л которого содержится 0,1 г NaOH. Диссоциацию щелочи считать полной.
4.7. Во сколько раз концентрация ионов водорода в крови (рН = 7,36) больше, чем в спинномозговой жидкости (рН = 7,53)?
4.8. Определить [H+] и [OH–] в растворе, рН которого равен 6,2.
4.9. Вычислить рН следующих растворов слабых электролитов: а) 0,02 М NH4OH; б) 0,1 М HCN; в) 0,05 н. HCOOH; г) 0,01 М CH3COOH.
4.10. Чему равна концентрация раствора уксусной кислоты, рН которого равен 5,2?
4.11. Вычислить значения 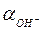 и
и 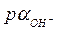 в 0,2 н. растворе NaOH, считая
в 0,2 н. растворе NaOH, считая 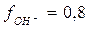 .
.
4.12. Используя данные табл. 3 Приложения, найти 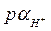 0,005 н. раствора HCl, содержащего, кроме того, 0,015 моль/л NaCl.
0,005 н. раствора HCl, содержащего, кроме того, 0,015 моль/л NaCl.
4.13. Степень диссоциации слабой одноосновной кислоты в 0,2 н. растворе равна 0,03. Вычислить значения [H+], [OH–] и pOH для этого раствора.
4.14. Рассчитать рН раствора, полученного смешением 25 мл 0,5 М раствора HCl, 10 мл 0,5 М раствора NaOH и 15 мл воды. Коэффициенты активности ионов принять равными единице.
4.15. Вычислить рН 0,1 н. раствора уксусной кислоты, содержащего, кроме того, 0,1 моль/л CH3COONa. Коэффициенты активности ионов считать равными единице.
4.16. Как изменится рН, если вдвое разбавить водой: а) 0,2 М раствор HCl; б) 0,2 М раствор CH3COOH; в) раствор, содержащий 0,1 моль/л CH3COOH и 0,1 моль/л CH3COONa?
4.17. Указать, какие из рядов перечисленных ниже кислот соответствуют возрастанию рН в растворах одинаковой молярной концентрации: а) HCN, HF, HOCl, HCOOH, CH2ClCOOH; б) HNO3, HNO2, CH3COOH, HCN; в) HCl, CH2ClCOOH, HF, H3BO3.
4.18. В 0,01 н. растворе одноосновной кислоты рН = 4. Какое утверждение о силе этой кислоты правильно: а) кислота слабая; б) кислота сильная.
4.19. Как изменится кислотность 0,2 н. раствора HCN при введении в него 0,5 моль/л KCN: а) возрастает; б) уменьшится; в) не изменится?
4.20. Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу: а) увеличить в 10 раз; б) увеличить на 1 моль/л; в) уменьшить в 10 раз; г) уменьшить на 1 моль/л?
4.21. Сколько ионов водорода содержится в 1 мл раствора, рН которого равен 13: а) 1013; б) 60,2∙1013; в) 6,02∙107; г) 6,02∙1010?
4.22. Как изменится рН воды, если к 10 л ее добавить 10–2 моль NaOH: а) возрастет на 2; б) возрастет на 3; в) возрастет на 4; г) уменьшится на 4?
ОБМЕННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Пример решения задач
Пример. Записать в ионно-молекулярной форме уравнения реакций между следующими веществами: CH3COONa и H2SO4; Na2CO3 и HNO3; HCN и Ca(OH)2; Pb(NO3)2 и K2CrO4.
Решение: Так как CH3COOH, HCN и H2O - слабые электролиты, а CO2 и PbCrO4 - малорастворимые в воде вещества, искомые уравнения будут иметь вид:
CH3COO– + H+ → CH3COOH
CO32– + 2H+ → CO2↑ + H2O
HCN + OH– → CN– + H2O
Pb2+ + CrO42– → PbCrO4↓
