Определение порядков электрохимических реакций
В общем случае выражения для скоростей катодного и анодного процессов могут быть представлены в виде:
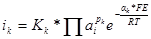 ;
; 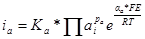
Здесь Kk* = KkKпр; Ka* = Ka/Kпс; рк и ра — порядки реакции по всем присутствующим в растворе веществам. Для каждого вещества р = νi/ν, где νi — стехиометрический коэффициент вещества в уравнении суммарной электродной реакции (берется положительным для окисленных веществ, стоящих в левой части уравнения реакции, и отрицательным для восстановленных); ν — число повторений замедленной стадии (всегда положительно).
В соответствии с последними уравнениями изменение активности одного из участников реакции при постоянной активности всех других веществ вызывает изменение скорости процесса при постоянном потенциале.
Рассмотрим влияние концентрации на скорость процесса на простом примере электродной реакции вида:
М2+ + 2е = M(Hg)
Поляризационные кривые при исходной концентрации ионов металла в растворе и амальгаме приведены на рис, 8.11
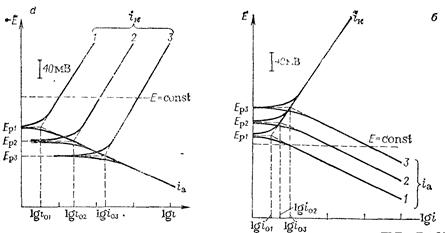
Рис. 8.11. Катодные и анодные поляризационные кривые при изменении активности ионов металла в растворе (а) и металла в амальгаме (б).
Кривые 2 и 3 соответствуют увеличению исходной активности в 10 и 100 раз.
(кривая 1). При увеличении концентрации (активности) ионов металла в растворе (рис. 8. 11, а) равновесный потенциал в соответствии с уравнением Нернста
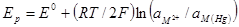
сдвинется в положительную сторону и примет значение Ер2, Ер3. Скорость катодного процесса согласно уравнению
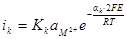
при Е = const возрастет, а наклон останется тем же. Скорость анодного процесса
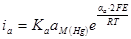
не зависит от концентрации ионов металла и, следовательно, не изменится.
Увеличение концентрации металла в амальгаме (рис. 8.11,6) вызывает сдвиг равновесного потенциала в отрицательную сторону и возрастание скорости анодного процесса; скорость катодного процесса остается неизменной. Плотность тока обмена с ростом активности ионов металла в растворе, а также при увеличении активности металла в амальгаме увеличивается.
Количественно определить порядок реакции можно, построив зависимость скорости процесса при постоянном потенциале (Е = = const) от активности вещества. Из уравнений для скорости процесса после их логарифмирования для данного конкретного случая следует, что:
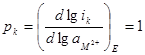 ;
; 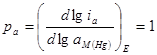
р = 1 означает, что рост активности в 10 раз вызывает десятикратное увеличение плотности тока.
Для определения порядка реакции строят зависимость lg i – lg aпри постоянном потенциале. В рассматриваемой реакции эта зависимость имеет наклон, равный единице. Положительный знак указывает, что при увеличении активности компонента происходит ускорение процесса, отрицательный знак свидетельствует о замедлении процесса.
В данном примере порядок реакции в катодном процессе: по
ионам металла 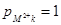 , по активности металла в амальгаме
, по активности металла в амальгаме
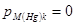 ; в анодном процессе: по активности металла в амаль-
; в анодном процессе: по активности металла в амаль-
гаме 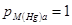 , по ионам металла
, по ионам металла 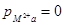 .
.
В случае простейших реакций их порядки непосредственно видны из уравнения реакции. В сложных многостадийных реакциях порядки могут быть определены экспериментально одним из существующих методов. Наиболее распространен указанный выше метод определения зависимости скорости процесса от активности (концентрации) вещества (компонента раствора) при постоянных активностях других компонентов. Так как уравнения, из которых определяют порядки, справедливы только при высоких перенапряжениях, то и порядки реакций определяют при этом же условии, т.е. Е = const выбирают на линейном участке полулогарифмической прямой. Поскольку тафелевские участки поляризационных кривых при изменении концентрации остаются параллельными (если не изменяется механизм процесса), то выбор Е = const не вызывает изменения порядка реакции.
Порядки электрохимических реакций можно определить также, найдя зависимость плотности тока обмена от активности (концентрации). Уравнение для скорости реакции при Е = Ер имеет вид:
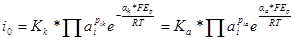
Логарифмируя, получим:
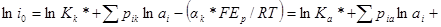
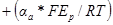
Запишем зависимость плотности тока обмена от активности вещества аj при постоянных активностях всех других компонентов:
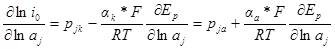
Из уравнения Нернста:
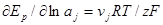
Подставим последнее выражение в предыдущее
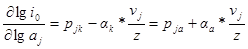
и далее в это уравнение — выражения для кажущихся коэффициентов переноса:
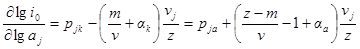
Из последнего уравнения порядки реакции по веществу в катодном и анодном процессах равны:
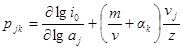
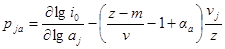
Так как αk + αa = 1, то
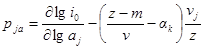
Разность порядков реакции в катодном и анодном процессах для одного и того же вещества равна:
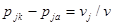
Следовательно, при ν = 1 разность порядков реакций катодного и анодного процессов равна стехиометрическому коэффициенту в уравнении суммарной электродной реакции.
Еще один метод определения порядков электрохимических реакций состоит в нахождении зависимости плотности тока обмена от равновесного потенциала. Метод основан на строгой зависимости равновесного потенциала от активности вещества, участвующего в электрохимической реакции. Запишем производную от плотности тока обмена по равновесному потенциалу в виде:
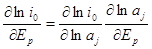
Подставляя в это уравнение выражения для зависимости равновесного потенциала и плотности тока обмена от активности, получаем
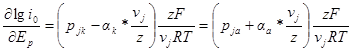
откуда
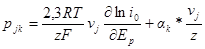
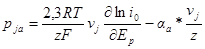
Достаточно надежно судить о механизме электрохимической реакции на основании установленных порядков реакции можно лишь в том случае, если последние определены как для катодного, так и для анодного процессов.
