При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов
aa + bb + . . . ® . . .
V = k • [A]a • [B]b • . . .
(используется молярная концентрация)
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Например:
С(графит) + О2(г) → СО2
Vпр.реакц. = k1∙Sc ∙ C(O2) = k ∙ C(O2)
Твёрдые вещества реагируют только с поверхности, константа будет зависеть от площади сосуда (Sc), но во времени не меняется.
Порядком реакции называется сумма всех показателей степеней концентрации в кинетическом уравнении (m + n).
ma + nb ® . . .
V = k • [A]m • [B]n
Различают реакции первого, второго и третьего порядка. Известны химические реакции нулевого порядка, когда m + n = 0. В случае нулевого порядка скорость реакции не зависит от концентрации реагентов. В качестве примера можно привести реакцию гидрирования этилена на платине:
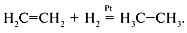
Cкорость данной реакции определяется поверхностью катализатора и не зависит от концентраций реагентов:
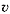 = k ∙ [C2H4]0[H2]0.
= k ∙ [C2H4]0[H2]0.
Встречаются химические реакции первого порядка (m + n = 1). К реакциям первого порядка относятся, как правило, процессы разложения. Известно небольшое число таких реакций. Например, разложение азометана в газовой фазе является реакцией первого порядка:
СН3–N=N–СН3 = С2Н6 + N2.
Скорость этой реакции зависит только от концентрации азометана:
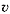 = k ∙ [(СH3)2N2].
= k ∙ [(СH3)2N2].
Процессы разложения:
2N2О5 = 4NО2 + O2, N2О4 = 2NО2
тоже относятся к реакциям первого порядка.
Не все реакции разложения имеют первый порядок. Так, реакциям разложения:
2NОСl = 2NO + Cl2, 2О3 = 3O2
соответствует второй порядок.
Окисление бромоводорода кислородом: 4HBr + O2 = 2Br2 + 2H2O
тоже относится к реакциям второго порядка, несмотря на то, что согласно уравнению с одной молекулой кислорода реагируют четыре молекулы бромоводорода. Это несоответствие записи уравнения реакции и выражения для ее скорости:
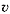 = k ∙ [О2][HBr]
= k ∙ [О2][HBr]
связано с тем, что данная реакция протекает в три стадии:
1) НВr + О2 = HО2Вr (лимитирующая стадия),
2) НО2Вr + НBr = 2НОВr,
3) 2НОBr + 2НВr = 2Н2О + 2Вr2,
_НВr + О2 = 2Н2О + 2Вr2.
Первая стадия в представленном механизме медленная. Вторая и третья стадии – быстрые, не лимитирующие процесс. Вот почему взаимодействие бромоводорода с кислородом относится к реакциям второго порядка – по уравнению 1) такой порядок имеет лимитирующий процесс.
Реакция 2NО (г.) + О2 (г.) = 2NО2 (г.) –
реакция второго порядка по NO и первого порядка по О2, в целом же – это реакция третьего порядка. Выражение для скорости реакции получения NО2:
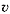 = k ∙ [NO]2[О2]
= k ∙ [NO]2[О2]
соответствует стехиометрии реакции, что является признаком ее одностадийности, одновременного столкновения трех молекул, приводящего к появлению диоксида азота.
Встречаются также реакции дробного порядка. К числу таких реакций относится образование фосгена в газовой фазе:
СО + Cl2 = СОCl2.
Выражение для скорости этой реакции имеет следующий вид:
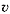 = k ∙ [CO][Cl2]3/2.
= k ∙ [CO][Cl2]3/2.
Разложение озона в присутствии хлора: 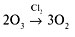
также является реакцией дробного порядка, протекающей со скоростью: 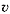 = k ∙ [О3]3/2.
= k ∙ [О3]3/2.
Лишь в редких случаях уравнение реакции отражает истинный механизм процесса, который обычно сложен и многостадиен.
Число молекул реагентов, участвующих в простой одностадийной реакции, состоящей из одного элементарного акта, называется молекулярностьюреакции.
Мономолекулярная реакция: C2H6 = 2 CH3.
Бимолекулярная реакция: CH3. + CH3. = C2H6
Примеры относительно редких тримолекулярных реакций:
2 NO + O2 = 2 NO2
2 NO + Cl2 = 2 NOCl
H. + H. + Ar = H2 + Ar
Большинство реакций являются многостадийными, даже если они описываются простыми стехиометрическими уравнениями. В этом случае скорость реакции зависит от лимитирующей стадии.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
| (t2 –t1) / 10 | ||
| Vt2 / Vt1 | = g |
t2 > t1
(где Vt2 и Vt1 -–скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции).
γ = k(Т + 10) / kТ
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
k = A • e –Ea/RT где,
A –постоянная, зависящая от природы реагирующих веществ (предэкспоненциальный множитель);
R –универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)];
k –константа скорости реакции;
Ea –энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
Логарифмирование уравнения Аррениуса:
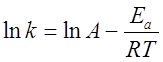 или
или 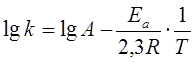
дает уравнение прямой линии. Знание констант скорости при нескольких температурах позволяет определить энергию активации данной реакции:
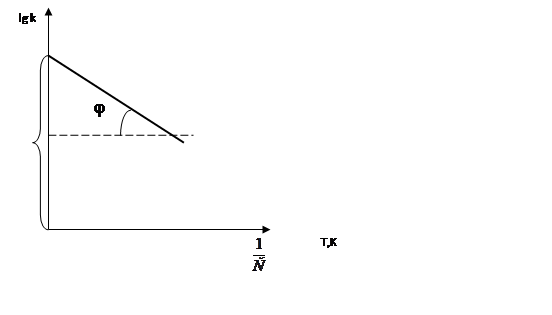
Тангенс угла наклона этой прямой к оси абсцисс равен:
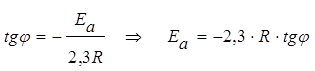 .
.
Энергия активации является тем фактором, посредством которого природа реагирующих веществ влияет на скорость химической реакции.
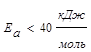 - «быстрые» реакции (ионные реакции в растворах);
- «быстрые» реакции (ионные реакции в растворах);
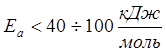 - реакции с измеряемой скоростью
- реакции с измеряемой скоростью
(Н2SO4 + Na2S2O3 = Na2SO4 + SO2 + S + H2O);
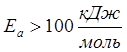 - «медленные» реакции
- «медленные» реакции
(синтез NH3 при обычных температурах).
