Основные теоретические положения. Атомы водорода в бензольных кольцах ароматических соединений способны замещаться на галогены (-Сl, -Вr)
Атомы водорода в бензольных кольцах ароматических соединений способны замещаться на галогены (-Сl, -Вr), остатки неорганических (-NО2, -SО3H) и органических (R-CO-) кислот, алкильные группы (-СН3, -СН2СН3, -СН(СН3)2 и др.). Характерной чертой этих реакций является участие в них электрофильных реагентов – частиц нуждающихся в электронах, часто положительно заряженных. Поэтому такой тип реакций называется электрофильным замещениеми обозначается SE.
Некоторые реакции электрофильного замещения бензола:
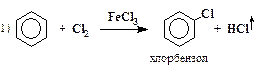 | хлорирование |
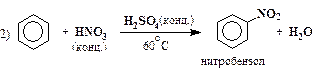 | нитрование |
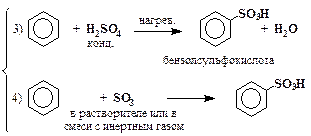 | сульфирование |
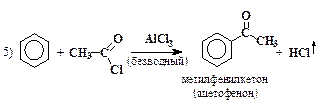 | Ацилирование по методу Фриделя-Крафтса |
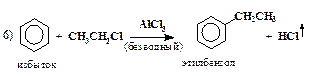 | алкилирование по методу Фриделя-Крафтса |
Все реакции электрофильного замещения проходят по одной общей схеме:
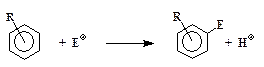
где Е+– электрофил, т.е. частица, "любящая электроны", R – заместитель в бензольном кольце, положение которого (орто-, мета- или пара) в этих формулах не указано.
Электрофилы образуются в результате кислотно-основных взаимодействий, как правило, в растворителях, способных сильно сольватировать ионы. Следовательно, в реакционных смесях SE-процессов обязательно должны присутствовать сильные протонные или апротонные кислоты: Н2SО4 (конц.), НNО3 (конц.), AlCl3 (безв.), FeCl3, BF3, SO3 и т.п.
В в реакциях (1 – 6) в качестве электрофилов выступают соответственно Cl+, NO2+, HSO3+, SO3, CH3CO+ и CH3CH2+.
Примером образования электрофила NO2+ – нитроний-катиона – является реакция:
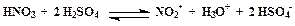
Доказано, что переходные состояния всех реакций электрофильного замещения бензола и его производных образуются в результате столкновения двух частиц, содержат как молекулу ароматического соединения, так и электрофил. Бимолекулярность реакции обозначают цифрой 2: SE2.
Известно также, что в переходном состоянии SE2-процесса еще сохраняется ковалентная связь между углеродным атомом бензольного кольца и уходящим атомом водорода.
Этим экспериментальным фактам соответствует следующий механизм реакций SE2:
1. Образование электрофила Е+ (см., напр., образование NO2+).
2. Образование p-комплекса (“пи-комплекса”):
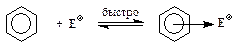
3. Образование s-комплекса (“сигма-комплекса”):
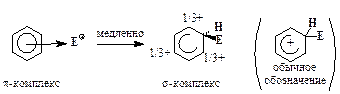
4. Отщепление протона:
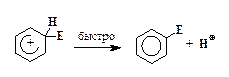
Для большинства реакций SE2 стадия 3, т. е. образование s-комплекса, требует наибольшей энергии активации, поэтому она проходит медленнее других стадий.
Та из последовательных стадий процесса, которая имеет наибольшую энергию активации, называется лимитирующей стадией. Образование s-комплекса – лимитирующая стадия процесса SE2. Чем легче образуется s-комплекс, тем быстрее проходит электрофильное замещение у соответствующего атома углерода в бензольном кольце.
Переход ароматического соединения в s-комплекс требует значительных затрат энергии. Во-первых, s-комплекс является карбокатионом, а карбокатионы, как известно, неустойчивы, и во-вторых, при образовании s-комплекса разрушается ароматическая p-электронная система и теряется энергия ароматической стабилизации. Атом углерода, присоединивший электрофильный реагент, из sp2-переходит в sp3-состояние и образуется не ароматическая разомкнутая π-система. У σ-комплекса 5 атомов углерода остаются в sp2-гибридном состоянии и их pz-орбитали образуют две связывающих, две разрыхляющих и одну несвязывающую орбиталь. Положительный заряд σ-комплекса, главным образом, находится на НСМО, т.е. в о- и п-положениях по отношению к sp3-гибридному атому углерода.
s-Комплекс по энергии близок к переходному состоянию рис. 15.
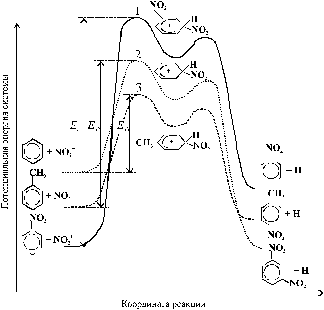
Рис. 15. Энергетические диаграммы нитрования ароматических соединений:
1 – нитробензола, 2 – бензола, 3 – толуола
В соответствии с принципом Хеммонда это означает, что они близки и по структуре). Видно также, что энергетические уровни s-комплексов и соответствующих переходных состояний меняются симбатно, т.е. рост энергии s-комплекса сопровождается увеличением энергии активации реакции. Можно сказать, что энергетический уровень s-комплекса предопределяет величину энергии активации реакции ароматического соединения.
Из рис. 15 следует, что при нитровании ароматических соединений величины энергии активации последовательно уменьшаются в ряду: нитробензол, бензол, толуол. В соответствии с этим при одинаковых условиях толуол нитруется легче, чем бензол, а бензол – легче, чем нитробензол.
От относительной легкости образования соответствующих s-комплексов зависит и преимущественное образование тех или иных изомеров при замещении в молекулах монозамещенных бензола. В общем виде образование различных изомеров при электрофильном замещении можно представить в виде схемы:
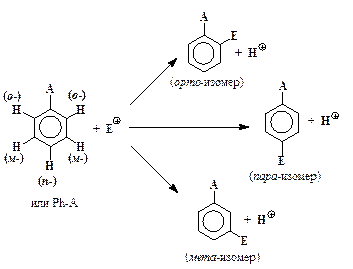
Электронодонорные заместители А (-NH2, -NHCH3, -N(CH3)2,
-OH, -OCH3, CH3, другие алкилы и т. д.) стабилизируют орто- и пара-s-комплексы, поэтому среди продуктов электрофильного замещения в молекулах соответствующих ароматических соединений преобладают орто- и пара- замещенные, а мета-изомеры образуются в небольших количествах (до 5 %). Такие заместители называются орто-, пара-ориентирующими или заместителями первого рода. Электронодонорные заместители облегчают электрофильное замещение в молекуле
Рh-А по сравнению с незамещенным бензолом Рh-Н, (см. энергетическую диаграмму).
Электроноакцепторные заместители:
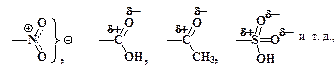
наоборот, способствуют энергетической дестабилизации s-комплексов, увеличивают Е реакций электрофильного замещения и уменьшают их скорость. Особенно сильное влияние они оказывают на орто- и пара-положения Ph-A. В их присутствии энергия активации замещения в мета-места ниже, чем в орто- и в пара-, поэтому они направляют электрофильные частицы Е+ преимущественно в мета-положение. Такие заместители называются мета-ориентирующими или заместителями второго рода.
Особенным образом в качестве заместителей ведут себя галогены. Они, являясь электроноакцепторами, несколько замедляют процессы SE2-типа, но при этом направляют атакующие электрофилы Е+ преимущественно в пара- и (в меньшей степени) в орто-положения.
Нафталин подвергается электрофильному замещению легче, чем бензол, так как оба возможных s-комплекса: a- и b- образуются легче, чем соответствующий s-комплекс бензола:
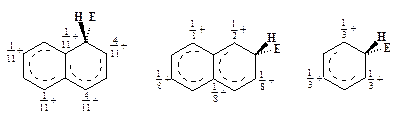
| a-s-комплекс | b-s-комплекс | s-комплекс бензола |
Легкость образования s-комплекса зависит от степени делокализации в нем положительного заряда. Об эффективности делокализации можно судить по величине суммы зарядов на атомах, соседних с тем, который изменил свое валентное состояние от sр2- до sр3- в результате присоединения к нему электрофила Е+. Чем больше эта сумма, тем меньше делокализован положительный заряд, тем сильнее дестабилизирован s-комплекс (его Епот на энергетической диаграмме выше), а значит и меньше реакционная способность ароматического соединения. Можно видеть, что соответствующие суммы SdÅ равны: у a-s-комплекса 1/11 + 4/11 = 5/11 = 0,454, у b-s-комплекса 1/2 + 1/8 = 5/8 = 0,625, у s-комплекса бензола 1/3 + 1/3 = 2/3 = 0,667. Найденные суммы соответствуют уменьшению реакционной способности в ряду: a-положение нафталина > b-положение нафталина > бензол.
Степень делокализации положительного заряда по углеродным атомам колец s-комплексов, образующихся из ароматических соединений бензоидного типа, можно оценить, пользуясь методом расчета, предложенным Лонге-Хиггинсом. Этот метод изложен в указании [8] (см. список литературы в конце этого пособия).
