Иначе говоря, если прямая реакция – экзотермическая, то обратная будет эндотермическая
Если все величины в уравнении разделить или умножить на определенное число, то равенство сохранится. Разделим в уравнении все величины на 2.
Н2(г) + 0,5О2(г) = Н2О (г) ∆Н = - 68,3 кка л/моль (или 242 кДж/моль)
Количество теплоты, выделяющейся (или поглощающейся) при образовании одного моля соединения из простых веществ, называется теплотой образования.
Например, выражение «теплота образования воды равна 68,3 ккал/моль», означает, что при образовании 18 г (1 моль) воды из простых веществ водорода и кислорода выделится 68,3 ккал теплоты.
Обратите внимание: в термохимических уравнениях часто используют дробные коэффициенты.
Кроме того, величина теплового эффекта зависит не только от природы веществ, но и от их агрегатного состояния, а также от температуры, при которой протекает реакция. Поэтому в термохимических уравнениях указывают агрегатное состояние веществ и измерения проводят всегда при постоянной температуре 250С и 1 атм давления (стандартные условия). Такие теплоты образования и сгорания называют стандартными. Они указаны в специальных таблицах. Энтальпия образования простых веществ принимается равной нулю
На практике часто используют понятие «теплота сгорания», это количество теплоты, выделяющейся при окислении одного моля какого-то соединения.
Например:С2Н2(г) + 2,5О2(г) = Н2О(г) + СО2(г) + 310,1 ккал/моль
Или С2Н2(г) + 2,5О2(г) = Н2О(г) + СО2(г) ; ∆Н = -310,1 ккал/моль
Здесь 310,1 ккал/моль - это теплота сгорания ацетилена.
Пользуясь табличными значениями теплоты образования и теплоты сгорания, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса(1841) – еще одна формулировка закона сохранения энергии: Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое. Математически это можно записать так:
ΔНхимической реакции= ΣΔНпродуктов реакции - Σν∙ΔНисходных веществ
Энтальпия химической реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом их стехиометрических коэффициентов.
Аналогично можно рассчитывать и другие термодинамические потенциалы. В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах и выделяется при образовании связей в продуктах реакции.
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
Закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
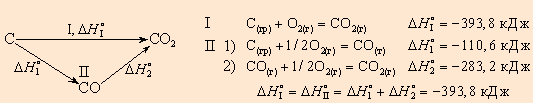 |
| Энтальпия первого пути равна сумме энтальпий отдельных стадий второго пути |
Практически важным выводом из закона Гесса и закона Лавуазье – Лапласа являетсявозможность вычислять тепловые эффекты в тех случаях, когда их нельзя измерить непосредственно.
