Электрохимическая коррозия металлов. 2.2.1 Электрохимическая электрокоррозия
2.2.1 Электрохимическая электрокоррозия. Электрическая коррозия (электрокоррозия) происходит под действием блуждающих токов, возникающих от посторонних источников (линии электропередач, электрические железные дороги, различные электроустановки, работающие на постоянном электрическом токе). Блуждающие токи вызывают коррозию газопроводов, нефтепроводов, электрокабелей, различных подземных металлических сооружений. Под влиянием блуждающих токов на находящихся в земле металлических предметах появляются участки входа и выхода электронов – катоды и аноды (рисунок 6).
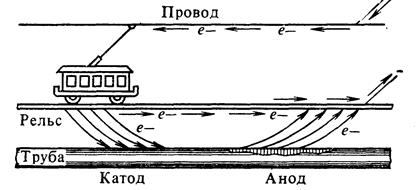
Рисунок 6 – Коррозия под действием блуждающих токов
Тщательное соблюдение требований к электрической изоляции (битум, полиэтилен) закладных изделий и правильной эксплуатации электрических сетей может исключить электрокоррозию, развивающуюся, главным образом, в городах и на предприятиях.
2.3Способы защиты от коррозии
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, снижением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла и др. При разработке методов защиты от коррозии используют указанные способы снижения скорости коррозии, которые меняются в зависимости от характера коррозии и условий ее протекания. Выбор того или иного способа определяется его эффективностью, а также экономической целесообразностью.
2.3.1 Легирование металла. Методы защиты, связанные с изменением свойств коррозирующего металла, осуществляются при помощи легирования. Легирование – эффективный (хотя обычно дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава обычно вводят компоненты, вызывающие пассивирование металла. В качестве таких компонентов применяются хром, никель, вольфрам и др.
Основное средство защиты металлов от газовой коррозии – легирование такими компонентами, которые улучшают свойства защитных пленок, образующихся при окислении металла. Для стали такими элементами являются хром, алюминий, кремний. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов. Из химически стойких по отношению к гальванокоррозии сплавов наиболее широкое применение имеют нержавеющие стали, в состав которых входят до 18 % хрома и до 10 % никеля.
2.3.2 Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии, называются защитными покрытиями. Если наряду с защитой от коррозии покрытие служит также для декоративных целей, его называют защитно-декоративным. Выбор вида покрытия зависит от условий, в которых используется металл.
Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение на их поверхность защитных пленок. При чем покрытия предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности защищаемого металла, и процесс коррозии возобновляется, причем в случае некоторых покрытий он даже ускоряется.
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. В зависимости от величины электродного потенциала защищаемого металла и покрытия, различают катодные и анодные покрытия (рисунок 7, 8).
Механизм электрохимической защиты металлов от коррозии позволяет рассмотреть течение коррозионных процессов в случаях механического повреждения металлических защитных покрытий. Здесь возможны два случая:
а) металл покрытия менее активен, чем защищаемый металл. Например, олово хорошо покрывает железо и достаточно стойко против действия разбавленных растворов кислот. В случае механического повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову; анодом здесь является железо, а катодом олово. В этом случае разрушается железо, а олово остается без изменений;
б) металл покрытия более активен, чем защищаемый металл. Например, покрытие железа цинком. При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом, а анодом — цинк, т. е. электроны переходят от цинка к железу, цинк разрушается, а железо остается защищенным до тех пор, пока не разрушится весь цинк. Из рассмотрения этих двух примеров можно сделать вывод, что из металлических защитных покрытий более надежным является покрытие металлом более активным, чем защищаемый металл.
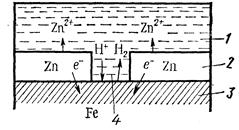
1 – раствор; 2 – покрытие; 3–основной материал; 4 – пора
Рисунок 7 – Схема коррозии металла в кислом растворе при нарушении анодного покрытия
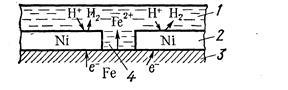
1 – раствор; 2 – покрытие; 3–основной материал; 4 – пора
Рисунок 8. Схема коррозии металла в кислом растворе при нарушении катодного покрытия
К ряду покрытий, получаемых химической обработкой металла, относятся защитные покрытия, образующиеся непосредственно на поверхности металла. Образование на поверхности металлических изделий защитных оксидных пленок носит в технике общее название оксидирование.
Неметаллические защитные покрытия могут быть как неорганическими, так и органическими. Защитное действие этих покрытий сводится в основном к изоляции металла от окружающей среды. В качестве неорганических покрытий могут быть неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной.
2.3.3 Электрохимические методы защиты. Методы электрохимической защиты основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды. К ним относятся катодная защита, называемая также электрозащитой, и протекторная (или анодная) защита.
Катодная защита заключается в том, что защищаемая конструкция А (рисунок 9), находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества В. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла Б (рельс, балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
Протекторная защитаотличается от катодной защиты тем, что для ее осуществления используется специальный анод – протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор Б(рисунок 10) соединяют с защищаемой конструкцией Апроводником электрического тока В. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения защищаемую конструкцию.

Рисунок 9 – Схема катодной Рисунок 10 – Схема анодной
защиты (протекторной) защиты
2.3.4 Изменение свойств коррозионной среды. Изменение свойств коррозионной средыпригодно для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Один из методов состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация). В качестве примера можно привести освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек.
Для замедления коррозии металлических изделий в агрессивную среду вводят вещества, называемые ингибиторами (или замедлителями) коррозии. Это имеет большое значение в тех случаях, когда металл необходимо защищать от разъедания кислотами.В зависимости от вида коррозии, природы металла и раствора применяются различные ингибиторы. При атмосферной коррозии применяют хорошо адсорбирующиеся на металле вещества: моноэтаноламин, карбонат аммония, уротропин, нитрит натрия. Для нейтральной коррозионной среды и растворов солей в качестве ингибиторов используют неорганические соли хромовых кислот, фосфорной, кремниевой, азотной и азотистой кислот. В кислых средах используют органические ингибиторы, содержащие атомы азота, серы, фосфора, кислорода и группировки атомов с ненасыщенными связями. Защитное действие ингибиторов обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металла и каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы, являющиеся сильными окислителями) переводят металл в пассивное состояние. Такие ингибиторы, вызывающие образование защитных оксидных пленок на поверхности металлов, называют пассиваторами.
Ингибиторы коррозии широко применяют при химической очистке паровых котлов от накипи, для снятия окалины с отработанных изделий, а также при хранении и перевозке соляной кислоты в стальной таре.
2.3.5 Создание рациональных конструкций. Выбор материалов и их сочетаний для данной машины, конечно, диктуется технической и экономической целесообразностью, но должен обеспечивать ее коррозионную устойчивость. Конструктор должен предусмотреть рациональные формы машины, допускающие быструю очистку от грязи; машина не должна иметь мест скопления влаги, которая является возбудителем коррозии.
Примеры решения задач
