Непредельные двухосновные карбоновые кислоты
Простейший представитель этого класса, бутендикарбоновая кислота, существует в виде двух геометрических изомеров:
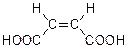 | 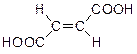 |
| малеиновая кислота (цис-изомер) | фумаровая кислота (транс-изомер) |
5. Ароматические карбоновые кислоты – это кислоты, в которых карбоксильные группы присоединены к бензольному кольцу.
| Формула кислоты | Название кислоты | Название кислотного остатка |
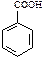 | бензойная | бензоат |
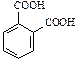 | фталевая | фталат |
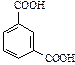 | изофталевая | изофталат |
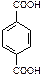 | терефталевая | терефталат |
Полифункциональные кислоты наряду с карбоксильной группой содержат другие функциональные группы:
6. Оксикислоты (гидроксикислоты) содержат одновременно гидроксильную и карбоксильную (одну или несколько) групп.
| Формула кислоты | Название кислоты | Название кислотного остатка |
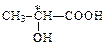 | молочная | лактат |
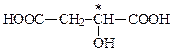 | яблочная | малат |
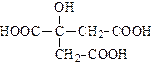 | лимонная | цитрат |
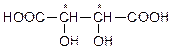 | винная | тартрат |
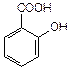 | салициловая | салицилат |
Молекулы оксикислот часто содержат асимметрические атомы углерода, то есть обладают оптической активностью:
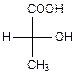 | ЗЕРКАЛО | 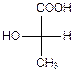 |
| d- молочная кислота | l- молочная кислота |
Для винной кислоты возможно существование трех изомеров:
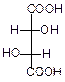 | 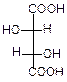 | 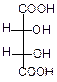 |
| d-виннаякислота | l-виннаякислота | мезовинная кислота |
| Смесь оптических изомеров – рацемат – носит название виноградной кислоты. | Имеет внутреннюю плоскость симметрии, оптически неактивна |
7. Оксокислоты содержат дополнительно альдегидную или кетонную группу.
| Формула кислоты | Название кислоты |
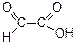 | глиоксиловая или глиоксалевая кислота, содержится в недозрелых фруктах |
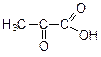 | пировиноградная кислота (соли – пируваты), является конечным продуктом метаболизма глюкозы в процессе гликолиза. |
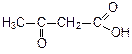 | ацетоуксусная кислота (соли – ацетилацетаты) |
Альдегидо- и кетокислоты встречаются в природных продуктах, некоторые из них играют важную роль в обмене веществ, являются промежуточными продуктами при спиртовом брожении сахаров.
8. Аминокислоты содержат одновременно амино- и карбоксильную группы. Изомерия и номенклатура аминокислот аналогичны таковым для оксикислот. В зависимости от взаимного расположения амино- и карбоксильной групп различают a, b, g и т.д. аминокислоты, например:
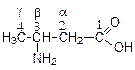 | 3-аминобутановая кислота (b-аминомасляная) |
Аминокислоты могут содержать одну, две или несколько аминогрупп и столько же карбоксильных групп. Аминокислоты широко распространены в природе.
Для аминокислот, как и для оксикислот возможно существование оптической изомерии. Природные аминокислоты относятся к L-ряду.
Физические свойства карбоновых кислот. При обычных условиях карбоновые кислоты – жидкости или твердые вещества, температуры плавления возрастают с увеличением длины углеродной цепи и числа карбоксильных групп. Высокие температуры кипения кислот связаны с образованием межмолекулярных водородных связей с участием неподеленных пар электронов атома кислорода при двойной связи и атомов водорода ОН-группы: кислоты существуют в виде димеров
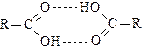
Низшие кислоты хорошо растворяются в воде, при увеличении числа атомов углерода растворимость уменьшается.
Химические свойства
Строение карбоксильной группы:
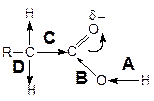
Смещение электронной плотности под действием полярной двойной С=О связи приводит к тому, что реакционными центрами в молекулах карбоновых кислот являются:
A.Связь О–Н карбоксильной группы.
B. Связь С–ОН карбоксильной группы.
C.Связь R–СООН.
D. Связь С–Н атома водорода в a-положении к карбоксильной группе.
A. Диссоциация карбоксильной группы с отщеплением катиона водорода:
RCOOH  RCOO– + H+
RCOO– + H+
(карбоновые кислоты проявляют свойства слабых кислот)
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта. Такие заместители, как хлор или фенильный радикал оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (-/). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект, +I. Они понижают кислотность.
В образующемся при диссоциации карбоксилат-анионе связи С–О выровнены, отрицательный заряд равномерно распределен между двумя атомами кислорода:
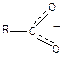
Поэтому двойная С=О связь в карбоновых кислотах неактивна.
Кислотные свойства карбоновых кислот:
2СH3COOH + Fe ® (СH3COO)2Fe + H2;
2CH3COOН + MgO ® (CH3COO)2Mg + H2O;
CH3COOH + KOH ® CH3COOK + H2O;
CH3COOH + NaHCO3 ® CH3COONa + CO2 + H2O.
B. Реакции с отщеплением гидроксильного ОН-радикала (нуклеофильное замещение в карбоновых кислотах, реакции ацилирования)
Реакции этерификации (взаимодействие со спиртами, приводящее к образованию сложных эфиров):
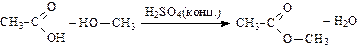
метиловый эфир уксусной кислоты (метилацетат)
Образование галогенангидридов:
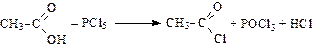
ацетилхлорид
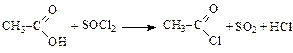
Реакции с аммиаком при нагревании (образование амидов):
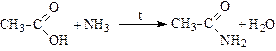
Получение ангидридов кислот при нагревании:
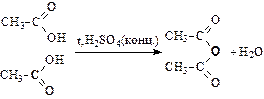 (уксусный ангидрид)
(уксусный ангидрид)
С. Декарбоксилирование (отщепление карбоксильной группы)
CH3COONa + NaOH 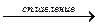 CH4 + Na2CO3
CH4 + Na2CO3
(СН3СОО)2Са 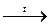 СН3СОСН3 + СаО + СО2
СН3СОСН3 + СаО + СО2
D. Реакции с участием углеводородного радикала
CH3–CH2–COOH + Сl2 ® CH3–CHCl–COOH + HCl
