Электролитов от законов рауля и вант-гоффа
Рассмотренные выше закономерности (первый и второй законы Рауля и закон Вант-Гоффа) оказались неприемлемыми для количественного описания коллигативных (т.е. зависящих только от числа частиц растворенного вещества) свойств растворов кислот, солей и оснований, проводящих ток. Такие растворы получили название растворов электролитов, в отличие от растворов неэлектролитов, не обладающих электропроводимостью.
Величиной, характерной для данного раствора электролита, является удельная электропроводность - электропроводность раствора объемом 1 см3, заключенного между электродами площадью 1 см2. Опытным путем обычно определяют не электропроводность, а электрическое сопротивление. Электропроводность является величиной, обратной сопротивлению:
χ = 1 / ρ,
где χ - удельная электропроводность; ρ - удельное электрическое сопротивление.
При разбавлении раствора удельная электропроводность уменьшается, так как уменьшается концентрация электролита. Электропроводность раствора, содержащего один моль-эквивалент растворенного вещества, объем которого заключен между двумя параллельно расположенными электродами, отстоящими друг от друга на расстоянии 1 см, называется эквивалентной электропроводностью. Очевидно, что эквивалентная электропроводность λ равна
λ = χ Vэ,
где Vэ - объем раствора, содержащего 1 моль-эквивалент растворенного вещества (разбавление раствора).
В отличие от удельной, эквивалентная электропроводность возрастает с уменьшением концентрации, стремясь к некоторому пределу (рис. 13).
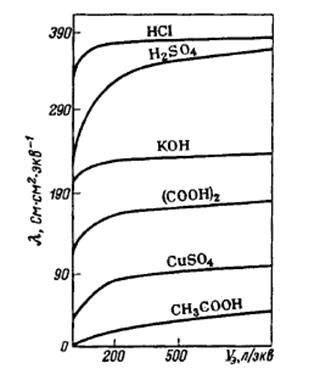
Рис. 13. Зависимость эквивалентной электропроводности от разбавления для водных растворов некоторых электролитов при 25°С
В 1887 г. Я.Г. Вант-Гофф установил, что определенное экспериментально осмотическое давление в растворах электролитов (солей, кислот и оснований) превышает вычисленное по уравнению
πоcм = СRT
Подобные отклонения измеренных величин от вычисленных по соответствующим уравнениям наблюдаются также для температуры кипения и температуры отвердевания растворов электролитов. По этой причине молекулярная масса, например, NaCl, определенная на основании криоскопических измерений, оказалась примерно равной 30 (действительная величина 58,6). Не зная, как можно объяснить эти отклонения, но стремясь приспособить уравнения, описывающие свойства растворов неэлектролитов, к растворам электролитов, Вант-Гофф ввел поправочный множитель i, названный изотоническим коэффициентом:
i = ∆Tоп / ∆Tтеор = ∆πосм(оп) / ∆πосм(теор) = ∆роп / ∆ртеор.
Подставляя коэффициент i в уравнение для расчета осмотического давления и в выражения законов Рауля, получаем соотношения, пригодные для описания свойств разбавленных растворов всех веществ, в том числе и для растворов солей, кислот и оснований:
∆Tотв = iКm;
∆Tкип = iЕm;
πосм = iCRT;
∆р = i∆ртеор
Коэффициент i зависит от природы раствора и его концентрации, но для одного и того же раствора значение i одинаково во всех четырех приведенных уравнениях. Например, для 1 М растворов некоторых электролитов изотонический коэффициент равен:
i(KCl) = 1.9; i(CuSO4) = 1.4; i(CH3COOH) = 1.05.
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем подобно закономерностям изменения эквивалентной электропроводности растворов солей, кислот и оснований коэффициент i растет при разбавлении раствора и стремится к некоторому целочисленному значению.
