Влияние катализатора на скорость реакции
Катализатором называется вещество, которое изменяет скорость реакции, участвует в реакции, но в конечные вещества не входит. Влияние катализатора на скорость реакции называется катализом. Скорость химической реакции в присутствии катализатора может увеличиваться (положительный катализ) или уменьшаться (отрицательный катализ, или ингибирование). В зависимости от того, находится ли катализатор в одной фазе с реагирующими веществами или образует отдельную фазу, различают гомогенный и гетерогенный катализ.
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, при этом общее число активных молекул возрастает, скорость реакции увеличивается.
Механизм действия катализатора может быть самым разнообразным и, как правило, очень сложным. В случае гомогенного катализа механизм действия катализатора связывают обычно с образованием активных промежуточных соединений. Например, химическая реакция
A + B = AB
в присутствии катализатора протекает в несколько стадий: катализатор взаимодействует с одним из веществ с образованием промежуточного соединения
A + kat = Akat,
затем промежуточное соединение Akat взаимодействует с другим исходным веществом В, образуя конечный продукт реакции и выделяя катализатор в его первоначальном виде:
Akat + B = AB + kat.
В случае положительного катализа (рис. 2) энергии активации всех промежуточных стадий реакции (Еак1 и Еак2) должны быть ниже энергии активации без катализатора (Еа).
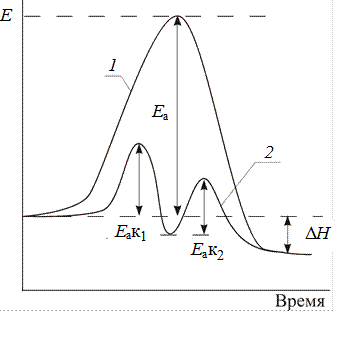
Рис. 2. Энергетическая схема реакции:
1 – без катализатора, 2 – с катализатором
Пример 7. Энергия активации некоторой реакции без катализатора Еа равна 75,4 кДж/моль, а с катализатором Еак = 53,0 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при 25 °С?
Решение. Обозначим константу скорости в присутствии катализатора kк. Воспользуемся уравнением Аррениуса (4.9):
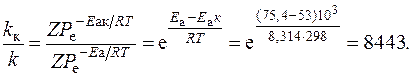
Таким образом, скорость реакции возрастет в 8443 раза.
ЗАДАЧИ
4.1. Как изменится скорость реакции SO2 + 2H2S = 3S + 2H2O: а) если увеличить концентрацию оксида серы (IV) в 3 раза; б) увеличить концентрацию сероводорода в 3 раза; в) увеличить концентрацию и оксида серы (IV) и сероводорода в 3 раза?
Ответ: а) увеличится в 3 раза; б) увеличится в 9 раз; в) увеличится в 27 раз.
4.2. Реакция протекает по уравнению O2 + 2SO2 = 2SO3. Как с помощью изменения концентраций реагирующих веществ увеличить скорость реакции в 9 раз? (Предложить минимум три варианта).
4.3. Температурный коэффициент скорости реакции равен 3,5. На сколько градусов нужно увеличить температуру, чтобы скорость реакции возросла: а) в 50 раз; б) в 150 раз?
Ответ: а) на 30 °С. б) на 40 °С.
4.4. При 20 °С скорость некоторой химической реакции равна 1 ммоль/(л∙с). При 80 °С скорость увеличивается до 100 ммоль/(л∙с). Рассчитать скорость реакции при температуре 50 °С.
Ответ: 9,9 ммоль/(л∙с).
4.5. Найти значение энергии активации реакции, если при повышении температуры от 100 до 130 °С ее скорость увеличилась в 20 раз.
Ответ: 124,8 кДж/моль.
4.6. Катализатор понижает энергию активации некоторой реакции на 20 кДж/моль. Во сколько раз увеличится скорость этой реакции, если ее проводить при температуре 30 °С?
Ответ: ~ в 2805 раз.
4.7. Написать выражение закона действия масс для следующих реакций:
а) 2H2 + O2 = 2H2O б) CO2 + C = 2CO
в) N2 + O2 = 2NO г) Fe2O3 + 3H2 = 2Fe + 3H2O
4.8. Как изменится скорость реакции 2NO + O2 = 2NO2: а) если давление увеличить в 3 раза; б) концентрацию оксида азота (II) уменьшить в 2 раза?
Ответ: а) увеличится в 27 раз, б) уменьшится в 4 раза.
4.9. При температуре 20 °С реакция протекает за 1 ч. Температурный коэффициент скорости реакции равен 2,5. При какой температуре реакция закончится за 5 мин?
Ответ: ~ 47 °С.
4.10. На сколько градусов нужно повысить температуру проведения некоторой реакции (g = 3), чтобы скорость ее возросла: а) в 20 раз; б) в 100 раз?
Ответ: а) ~ на 27 град; б) ~ на 42 град.
4.11. Энергия активации некоторой реакции составляет 98,12 кДж/моль, при введении катализатора энергия активации снижается до 79,81 кДж/моль. Во сколько раз увеличится скорость реакции, протекающей в присутствии катализатора при температуре 100 °С?
Ответ: ~ в 367 раз.
4.12. Катализатор снижает энергию активации некоторой реакции на 22 кДж/моль. Рассчитать, как изменится скорость этой реакции в присутствии катализатора при температуре 75 °С.
Ответ: ~ в 2006 раз.
4.13. Как изменится скорость реакции 2NO + Cl2 = 2NOCl, если одновременно концентрацию оксида азота (II) увеличить в 3 раза, а концентрацию хлора уменьшить в 3 раза?
Ответ: увеличится в 3 раза.
4.14. Во сколько раз увеличится скорость реакции:
а) 2Fe + O2 = 2FeO б) 4P + 5O2 = 2P2O5
в) 4Al + 3O2 = 2Al2O3
если их проводить не на воздухе, а в среде чистого кислорода? (Концентрацию кислорода в воздухе принять за 20 % об.)
Ответ: а) в 5 раз; б) в 3125 раз; в) в 125 раз.
4.15. При увеличении температуры от 30 до 60 °С скорость реакции возросла в 64 раза. Как изменится скорость этой реакции при уменьшении температуры от 30 до 20 °С?
Ответ: уменьшится в 4 раза.
4.16. Температурный коэффициент скорости некоторой реакции равен 2,2. При температуре 300 °С константа скорости реакции равна 2∙10-3. Найти константу скорости при 400 °С.
Ответ: 5,31.
4.17. При уменьшении температуры от 40 до 20 °С реакция замедлилась в 10 раз. Рассчитать энергию активации этой реакции.
Ответ: 87,78 кДж/моль.
4.18. При 20 °С в присутствии катализатора реакция протекает в 10000 раз быстрее, чем без катализатора. Найти энергию активации реакции с катализатором, если энергия активации без катализатора равна 101,8 кДж/моль.
Ответ: 79,36 кДж/моль.
4.19. Написать выражение закона действия масс для реакции 2Fe + 3Cl2 = 2FeCl3. Во сколько раз увеличится скорость реакции, если объем реакционного сосуда уменьшить в 2,5 раза?
Ответ: увеличится в 15,625 раз.
4.20. Гомогенная реакция протекает по уравнению 3A2 + B2 = 2A3B. Концентрацию В2 уменьшили в 15 раз. Как нужно изменить концентрацию А2, чтобы скорость прямой реакции осталась прежней?
Ответ: увеличить в 2,47 раза.
4.21. Температурный коэффициент скорости некоторой реакции равен 2,8. Как изменится скорость реакции: а) при увеличении температуры на 30 °С; б) увеличении температуры на 70 °С; в) уменьшении температуры на 50 °С?
Ответ: а) увеличится ~ в 22 раза; б) увеличится ~ в 1350 раз; в) уменьшится в 172 раза.
4.22. Константа скорости реакции при 0 и 40 °С равна 2∙10-3 и 0,1 соответственно. Определить температурный коэффициент скорости этой реакции.
Ответ: ~ 2,66.
4.23. Как нужно изменить давление, чтобы скорость реакции 2CO + O2 = 2CO2: а) увеличилась в 100 раз; б) уменьшилась в 10 раз?
Ответ: а) увеличить в 4,64 раза; б) уменьшить в 2,15 раз.
4.24. Гомогенная реакция протекает по уравнению 4NH3 + 5O2 = 4NO + 6H2O. Как измениться скорость реакции, если объем реакционного сосуда уменьшить в 2 раза?
Ответ: увеличится в 512 раз.
4.25. При понижении температуры на 60 °С реакция замедлилась в 64 раза. Определить температурный коэффициент скорости этой реакции.
Ответ: 2.
4.26. При какой температуре реакция закончится через 20 мин, если при температуре 20 °С для завершения реакции требуется 3 ч. Температурный коэффициент реакции равен 3.
Ответ: 40°С.
4.27. Энергия активации реакции равна 74,44 кДж/моль. Во сколько раз изменится скорость реакции, если увеличить температуру проведения реакции от 0 до 30 °С?
Ответ: ~ в 26 раз.
4.28. При температуре 0 °С реакция протекает со скоростью 2 моль/(л∙мин), при температуре 50 °С – 80 моль/(л∙мин). Рассчитать скорость реакции при температуре 30 °С.
Ответ: 18,3 моль/(л∙мин).
4.29. Рассчитать энергию активации реакции, если константы скорости при 25 и 50 °С соответственно равны 0,4 и 22.
Ответ: 128,3 кДж/моль.
4.30. Как изменится скорость реакции CO + 3H2 = CH4 + H2O: а) если увеличить давление в 3 раза; б) уменьшить объем системы в 2 раза; в) увеличить концентрацию водорода в 4 раза?
Ответ:а) увеличится в 81 раз; б) увеличится в 16 раз; в) увеличится в 64 раза.
