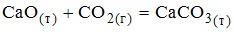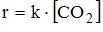Iii. классы неорганических соединений
II. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
1. Наибольшей полярностью в молекуле уксусной кислоты характеризуется связь между атомами водорода и кислорода
2. Формула вещества, в котором валентные орбитали центрального атома находятся в sp-гибридном состоянии, имеет вид BeF2
3. Частицей, для которой характерен донорно-акцепторный механизм образования химической связи, является BF4(-)
4. В узлах кристаллической решетки хлорида калия располагаются ионы калия и хлора
5. Формула молекулы вещества, в которой реализуется только ковалентный полярный тип связи, имеет вид HCl
6. Формула вещества, в молекуле которого содержатся пи-связи, имеет вид N2
7. Формула молекулы с наибольшей полярностью связи Э−Н имеет вид HF
8. Формула вещества, в молекулах которого валентные орбитали центрального атома находятся в sp-гибридном состоянии, имеет вид CO2
9. Наибольшее число пи-связей содержится в молекуле N2
10. Формула вещества, в молекуле которого атомы расположены в одной плоскости, имеет вид HNO3
11. Атомной кристаллической решеткой обладает вещество, формула которого имеет вид SiO2
12. Число общих электронных пар, участвующих в образовании связей в молекуле фосгена – COCl2, равно 4
13. Наибольшей полярностью в молекуле уксусной кислоты характеризуется связь между атомами водорода и кислорода
14. Формула вещества, в молекуле которого содержится одинаковое число сигма- и пи-связей, имеет вид CO2
III. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1. В схеме превращений CuSO4-->CuCl2-->Cu(OH)2 веществами Х и Y являются BaCl2 и KOH
2. Формулы гидроксидов, проявляющих только
основные свойства, имеют вид Mg(OH)2 и Ba(OH)2
3. Формулы гидроксидов, которые которые нельзя получить растворением соответствующих оксидов в воде, имеют вид Mg(OH)2 Zn(OH)2
4. Формула гидроксида, который можно получить растворением в воде его оксида, имеет видKOH
5. Формула оксида, при растворении которого вводе образуется кислота общей формулы H2ЭО4 имеет вид SO3
6. Формула кислоты, для которой характерно образование кислых солей, имеет вид H3PO4
7. Формула вещества, относящегося к классу кислых солей, имеет вид NaHCO3
8. При пропускании оксида серы (IV) в раствор щелочи возможно образование ___ и ____ солей. кислой и средней
9. Формулы оксидов, которые при растворении в воде образуют кислоты общей формулы H2ЭО3, имеют вид SO2 и CO2
10. Формулы гидроксидов, которые реагируют с водными растворами и кислот, и оснований, имеют вид Zn(OH)2 и Al(OH)3
11. В схеме превращений Fe-->FeCl3-->Fe(NO3)3 веществами Х и Y являются Cl2 и AgNO3
12. В схеме превращений Na-->NaOH-->NaHSO3 веществами Х и Y являются H2O и SO2
13. В схеме превращений NaOH-->NaHCO3-->CO2 веществами Х и Y являются CO2 и HCl
14. При пропускании аммиака в раствор ортофосфорной кислоты образуются соли, формулы которых имеют вид ____ и ____. NH4H2PO4 и (NH4)2HPO4
IV. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
1. Масса серной кислоты, содержащейся в 1 мл раствора с молярной концентрацией эквивалентов H2SO4 равной 2 моль/л, составляет 98 мг (с точностью до целого значения).
2. Массовая доля хлорида кальция в растворе, полученном при растворении 20 г CaCl2 и 180 г воды, составляет 10 % (с точностью до целого значения).
3. Моляльная концентрация сульфата меди (II) в растворе, полученном при растворении 16 г CuSO4 в 100 г воды, составляет 1 моль/кг (с точностью до целого значения).
4. Масса сульфата магния, необходимого для приготовления 500 мл раствора с молярной концентрацией растворенного вещества 0,5 моль/л, составляет 30 г (с точностью до
целого значения).
5. Объем хлороводорода (н.у.), который содержится в 847,5 мл 36,5 %-го раствора соляной кислоты (ро=1,18 г/см3 ), составляет 224 литра (с точностью до целого значения).
6. Масса кристаллогидрата (MgSO4*7H2O ), необходимого для приготовления 1000 г раствора сульфата магния с массовой долей растворенного вещества 6%, составляет 123 г (с точностью до целого значения).
7. Массовая доля гидроксида натрия в растворе, полученном при разбавлении 200 мл 2,5М раствора NaOH в 5 раз, составляет 2 % (с точностью до целого значения;ро раствора=1г/см3).
8. Массовая доля сульфата меди (II) в растворе, полученном при растворении 50 г медного купороса (CuSO4*5H2O ) в 350 мл воды, составляет 8 % (с точностью до целого значения).
9. 100 г 40%-ного раствора гидроксида натрия разбавили водой до объема 500 мл. Молярная концентрация эквивалентов NaOH в полученном растворе составляет 2 моль/л(с точностью до целого значения).
10. Масса медного купороса, необходимого для приготовления 500 мл раствора сульфата меди (II) с массовой долей растворенного вещества 3,2%(ро=1г/см3) , составляет 25 г(с точностью до целого значения).
11. Объем хлороводорода ( н.у.), который содержится в 50 литрах 0,1 М раствора соляной кислоты, составляет 112 литров (с точностью до целого значения).
12. Для приготовления 10 л 0,1 М раствора гидроксида натрия требуется 40 г твердой щелочи (с точностью до целого значения).
13. Масса кристаллогидрата (Na2CO3*10H2O ), необходимая для приготовления 500 г раствора карбоната натрия с массовой долей растворенного вещества 10,6%, составляет 143 г (с точностью до целого значения).
14. Массовая доля хлорида кальция в растворе, полученном при смешении 300 г раствора с массовой долей CaCl2 15% и 200 г раствора с массовой долей 2,5%, составляет 10 %(с точностью до целого значения).
15. Объем хлороводорода (н.у.), который необходим для приготовления 20 литров 0,5 М раствора соляной кислоты, составляет 224 литра (с точностью до целого значения).
V. РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
1. Формула соли, в водном растворе которой индикатор лакмус приобретает красную окраску, имеет вид CuSO4
2. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению
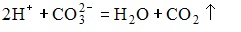
имеет вид Na2CO3+H2SO4-->
3. Формула соли, процесс гидролиза которой в водном растворе протекает практически до конца, имеет вид Al2(CO3)3
4. Наибольшее число катионов образуется при диссоциации в воде 1 моль соли, формула которой Na3PO4
5. Схема реакции, соответствующая сокращенному молекулярно-ионному
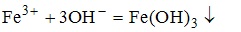
имеет вид FeCl3+NaOH-->
6. Схема реакции, соответствующая сокращенному молекулярно-ионному
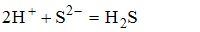
имеет вид K2S+H2SO4--->
7. Наибольшее число ионов образуется при диссоциации в воде 1 моль соли, формула которой имеет вид Al(NO3)3
8. Сильным электролитом является раствор вещества, формула которого имеет вид Al2(SO4)3
9. Формула соли, в водном растворе которой индикатор метиловый оранжевый приобретает желтую окраску, имеет вид Na3PO4
10. Формула соли, в водном растворе которой индикатор фенолфталеин приобретает малиновую окраску, имеет вид K2HPO4
11. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению
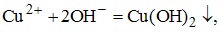
имеет вид CuSO4+NaOH-->
12. Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид
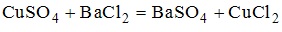
13. Формула соли, значение рН водного раствора которой равно 7, имеет вид K2SO4
14. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению
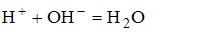
имеет вид H2SO4+KOH--->
15. Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид
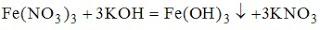
16. Формула соли, водный раствор которой характеризуется рН <7, имеет вид CuSO4
17. Наибольшее число ионов образуется при диссоциации 1 моль соли, имеющей формулу Fe2(SO4)3
VI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
1. Для ОВР молярная масса вещества восстановителя равна 34 г/моль.
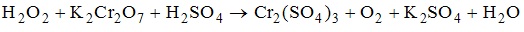
2. Схема процесса, в котором происходит восстановление серы, имеет вид SO3(2-)-->S
3. Коэффициент перед формулой восстановителя в уравнении окислительно-восстановительной реакции равен 3
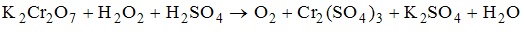
4. К окислительно-восстановительным относится реакция, схема которой имеет вид
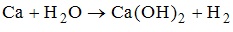
5. Сумма коэффициентов в уравнении окислительно-восстановительной реакции равна 21
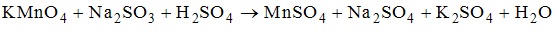
6. Схема, которая соответствует процессу окисления, имеет вид P(0)-->P(+5)
7. Формула вещества, которое в окислительно-восстановительной реакции
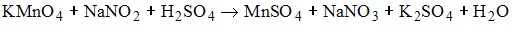
проявляет восстановительные свойства, имеет вид NaNO2
8. Схема процесса, в котором происходит окисление азота, имеет вид NH4(+)-->N2O
9. Формула вещества, которое способно проявлять только восстановительные свойства, имеет вид NaI
10. Формула вещества, которое способно проявлять свойства как окислителя, так и восстановителя, имеет вид HNO2
11. Коэффициент перед формулой восстановителя в уравнении окислительно- восстановительной реакции равен 10
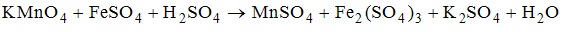
12. В окислительно-восстановительной реакции
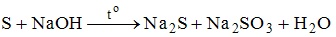
сера является и окислителем, и восстановителем
13. Число электронов, которое принимает 1 моль окислителя в окислительно-восстановительной реакции равно 6
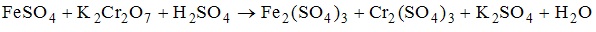
14. Молярная масса вещества-окислителя в окислительно-восстановительной реакции, схема которой имеет вид , равна 167 г/моль.
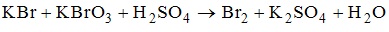
15. Число моль электронов, которое отдает 1 моль восстановителя в ОВР реакции , равно 2
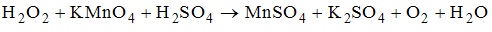
16. Число моль электронов, которое принимает 1 моль окислителя в ОВР реакции равно 8
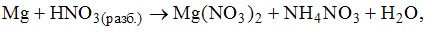
17. Коэффициент перед формулой окислителя в уравнении окислительно-восстановительной реакции равен 1
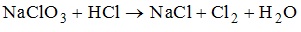
VII. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ
1. Наименьшей растворимостью (моль/л) обладает карбонат двухвалентного металла, значение произведения растворимости которого равно 7.5*10^-14
2. Наименьшей растворимостью обладает гидроксид двухвалентного металла, значение произведения растворимости которого равно 2.2*10^-20
3. При разбавлении ацетатного буферного раствора в два раза значение величины pH не изменится
4. Масса гидроксида натрия, содержащаяся в 1 л его раствора, значение рН которого равно 12, составляет 0,4 г (альфа=1)
5. Значение рН раствора, полученного путем разбавления 0,05 М раствора серной кислоты (α = 1) в 10 раз, равно 2,0
6. Формула вещества, 0,01 М раствор которого характеризуется наибольшим значением рН, имеет вид KOH
7. Масса гидроксида калия, содержащаяся в 10 л его раствора, значение рН которого равно 11 составляет 0,56 г (альфа=1)
8. Масса ионов кальция, содержащаяся в 5 л насыщенного раствора карбоната кальция, равна 13,8 мг (ПР(CaCO3)=4,8*10^-9)
9. Формула вещества, 0,01 М раствор которого характеризуется наименьшим значением рН,имеет вид HNO3
10. Формула вещества, 0,01 М раствор которого характеризуется наименьшим значением рН, имеет вид HClO4
11. Масса карбоната кальция, содержащаяся в
1 л насыщенного раствора, равна 6,9 мг (ПР(CaCO3)=4,8*10^-9)
VIII. КАЧЕСТВЕННЫЙ АНАЛИЗ
1. Обнаружить ионы свинца (II) в присутствии ионов бария можно действием раствора KI
2. Формула реагента, действием которого можно обнаружить присутствие в растворе ионов железа (III), имеет вид NH4SCN
3. Отделить ионы Mg(2+) от ионов Zn(2+) можно действием раствора KOH
4. При действии избытка водного раствора аммиака на раствор, содержащий ионы Al(3+), Fe(3+), Zn(2+), Cu(2+) , в осадок выпадают Al(OH)3 и Fe(OH)3
5. Реагентом, действием которого можно обнаружить присутствие ионов NH4(+) в
растворе, является NaOH
6. Определить ионы калия в растворе можно действием реагента, формула которого имеет вид Na3[Co(NO2)6]
7. Действие водного раствора аммиака используется для обнаружения в исследуемом растворе ионов Cu(2+)
8. Действием подкисленного раствора перманганата калия можно обнаружить в растворе ионы NO2(-)
9. Реагентом, действием которого можно обнаружить присутствие ионов Fe(3+) в растворе, является K4[Fe(CN)6]
10. Соли калия окрашивают пламя горелки или спиртовки в фиолетовый цвет.
IX. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
1. Объем раствора гидроксида бария с молярной концентрацией эквивалентов 0,1 моль/л, необходимый для нейтрализации 25 мл раствора соляной кислоты c молярной концентрацией эквивалентов 0,2 моль/л, равен 50 мл.
2. Объем 0,1 М раствора NaOH , необходимый для нейтрализации раствора серной кислоты, содержащего 0,147 г H2SO4 , равен 30 мл.
3. Объем 0,1 М раствора NaOH, необходимый для нейтрализации раствора соляной кислоты, содержащего 0,073 г HCl, равен 20 мл.
4. При определении общей жесткости воды методом комплексонометрического титрования в качестве индикатора может быть использован эриохром черный
5. При сливании 30 мл 0,1М раствора CaCl2 20 мл 0,2М раствора (NH4)2C2O4 образуется осадок массой 0,384 г.
6. Для нейтрализации 25 мл раствора гидроксида калия c молярной концентрацией эквивалентов 0,2 моль/л требуется 50 мл раствора серной кислоты c молярной концентрацией эквивалентов 0,1 моль/л.
7. В аналитических лабораториях общую жесткость воды определяют методомкомплексонометрического титрования.
8. Объем 0,1М раствора карбоната натрия, необходимый для осаждения ионов кальция из раствора, содержащего 0,324 г его гидрокарбоната, равен 20 мл.
X. ФИЗИКО-ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
1. В потенциометрическом методе анализа от значения концентрации потенциалопределяющего иона зависит величина потенциала индикаторного электрода
2. Самопроизвольный распад ядер некоторых изотопов, на котором основаны ядерно-химические методы анализа, называется радиоактивным
3. Величина интенсивности электромагнитного излучения при прохождении через анализируемый образец в методе атомно- абсорбционной спектроскопии уменьшается
4. Метод потенциометрии основан на зависимости электродного потенциала от концентрации потенциалопределяющих ионов, которая характеризуется уравнением Нернста
5. Методы анализа, основанные на различной сорбционной способности определяемых веществ, называются хроматографическими
6. В методе потенциометрии аналитическим сигналом, значение которого линейно зависит от концентрации анализируемого вещества, является потенциал электрода
7. Согласно закону светопоглощения, на котором основаны спектрофотометрические методы анализа, зависимость оптической плотности от концентрации светопоглощающего вещества имеет линейный вид.
8. Свечение атомов или молекул, возникающее при переходах электронов из возбужденного состояния в основное, называется люминесценцией
9. Методы анализа, основанные на различной электропроводности растворов или расплавов определяемых веществ, называются кондуктометрическими
10. Методы анализа, основанные на различной электропроводности растворов или расплавов определяемых веществ, называются кондуктометрическими
11. Методы анализа, основанные на различной сорбционной способности определяемых веществ, называются хроматографическими
XI. ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
1. Энтальпия образования NaNO3 соответствует тепловому эффекту реакции Na+1/2N2+3/2O2=NaNO3
2. Согласно второму началу термодинамики, в изолированных системах самопроизвольно могут протекать процессы, для которых справедливо выражение dS>=0
3. Согласно термохимическому уравнению
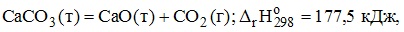
для получения 560 г оксида кальция требуется затратить 1775 кДж теплоты.
4. Если для реакции
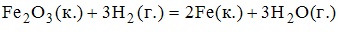
dH=96.74 кДж, dS=-141Дж/К то температура, при
которой возможно ее протекание в прямом и обратном направлении, равна 413 C (зависимостью термодинамических функций от температуры пренебречь).
5.
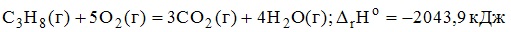
объем пропана (н.у),который необходим для получения 10000 кДж теплоты,составляет 109,6 л.
6. Энтальпия образования Na2SO4 соответствует тепловому эффекту реакции 2Na+S+2O2=Na2SO4
7. Процесс, протекающий при постоянном значении давления в системе, называется изобарическим
8. Согласно второму началу термодинамики, состояние равновесия реализуется в изолированных системах, для которых справедливо выражение dS=0
9. Энтальпия образования K2SiO3 соответствует тепловому эффекту реакции
2K+Si+3/2O2=K2SiO3
10. Если для реакции CO(г)+2H2(г)=CH3OH(г) dH=-128,2 кДж и dS=-332,1 Дж/К то температура, при которой возможно ее протекание в прямом и обратном направлениях, равна 113 С (зависимостью термодинамических функций от температуры пренебречь).
11. Согласно второму началу термодинамики в изолированных системах самопроизвольно протекают процессы, для которых справедливо выражение dS>0
12. Энтальпия образования CaCO3 соответствует тепловому эффекту реакции
Ca+C+3/2O2=CaCO3
13. Энтальпия образования BaSO4 соответствует тепловому эффекту реакции
Ba+S+2O2=BaSO4
14. Формула для расчета теплового эффекта химической реакции
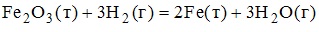 имеет вид
имеет вид
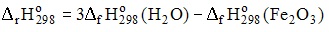
15. Процесс, протекающий при постоянном значении количества теплоты в системе, называется адиабатическим
XII. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ
1. Уравнение реакции, скорость которой практически не зависит от изменения давления, имеет вид Cr2O3+2Al=2Cr+Al2O3
2. Уравнение реакции, скорость которой при стандартных условиях практически не зависит от изменения давления, имеет вид CaO+SiO2=CaSiO3
3. При увеличении давления в системе в 2 раза скорость элементарной гомогенной реакции
A2+B2=2AB увеличится в 4 раза
4. Если температурный коэффициент скорости равен 2, то при увеличении температуры от 20С до 50С скорость химической реакции увеличится в 8 раз.
5. Для увеличения скорости элементарной гомогенной реакции 2NO+Cl2=2NOCl в 64 раза необходимо увеличить давление в ___ раз(а).
6. Если температурный коэффициент скорости равен 2, то при увеличении температуры от 120С до 170С скорость химической реакции увеличится в 32 раз(а).
7. Выражение закона действующих масс для скорости прямой реакции
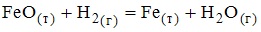
при условии ее элементарности имеет вид
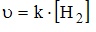
8. Скорость химической реакции увеличилась в 16 раз при повышении температуры от 20C до 60C. Температурный коэффициент скорости данной реакции равен 2
9. Если температурный коэффициент скорости равен 3, то при увеличении температуры от 20С до 60С скорость химической реакции увеличится в 81 раз.
10. При увеличении объема реакционной смеси в 2 раза скорость элементарной гомогенной реакции 2CO+O2=2CO2 уменьшится в 8 раз
11. При увеличении давления в реакционной смеси в 2 раза скорость элементарной гомогенной реакции 2NO+Cl2=2NOCl увеличится в 8 раз.
12. Увеличение скорости химической реакции при введении катализатора происходит в результате уменьшения энергии активации
13. Выражение закона действующих масс для скорости прямой реакции
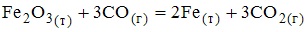
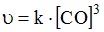
при условии ее элементарности имеет вид
14. Выражение закона действующих масс для скорости прямой реакции имеет вид