Задания для самостоятельной работы. 1.Рассчитайте изменение энтропии, энтальпии и энергии Гиббса при с.у
1.Рассчитайте изменение энтропии, энтальпии и энергии Гиббса при с.у. для реакции гидролиза мочевины СО(NН2)2(ж) + Н2О(ж) = СО2(ж) + 2 NН3(ж).
2.Рассчитайте изменение энтропии, энтальпии и энергии Гиббса реакции образования глицилглицина 2 СН2(NН2)СООН(ж) → СН2(NН2)СОNНСН2СООН(ж) + Н2О(ж) при 298К.
3.Для реакции 2 NO2(г) ↔ N2О4(г) вычислите ΔG°р и температуру, при которой оба направления процесса равновероятны.
4.Рассчитайте изменение энтропии, энтальпии и энергии Гиббса реакции окисления этанола в уксусный альдегид С2Н5ОН(ж) + О2(г) ↔ СН3СНО(г) + Н2О(ж) при с.у.
5.Глицерин – один из продуктов метаболизма, который окончательно превращается в организме в СО2(г) и Н2О(ж). Рассчитайте изменение энтропии, энтальпии и энергии Гиббса для этой реакции при 298 К.
6.РеакциейС6Н12О6(ж) → С3Н7СООН(ж) + 2 СО2(г) + 2Н2(г) выражается один из путей метаболизма глюкозы. Рассчитайте изменение энтропии, энтальпии и энергии Гиббса для этой реакции при с.у.
7.Рассчитайте изменение энтропии, энтальпии и энергии Гиббса при с.у. для реакции СО(г) + Сl2(г) ↔ СОСl2(г).
8.Рассчитайте изменение энтропии, энтальпии и энергии Гиббса для реакции фотосинтеза, протекающей в организме: 6 СО2(г) + 6 Н2О(ж) ↔ С6Н12О6(ж) + 6О2(г) при 298 К.
9. Вычислите среднюю скорость реакции А → В, если начальная концентрация исходного вещества 6 моль/л, а через 2 мин – 2 моль/л.
10. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергия активации (Ea) уменьшить на 4 кДж/моль?
11. Вычислите энергию активации в указанном интервале температур, если константа скорости разложения оксида азота (V) при 35 оС равна 8,76·10-3 мин-1, а при 45оС увеличивается до 2,99·10-2 мин-1.
12. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий -192. Рассчитайте, какая часть введенного радионуклида останется в опухоли через 10 суток, если его период полупревращения составляет 74,08 суток.
13. Вычислите температурный коэффициент константы скорости разложения пероксида водорода в температурном интервале 25-55оС при Ea = 75, 4 кДж/моль.
14. Как измениться скорость прямой реакции: 2 СО(г) + О2(г)↔ 2 СО2(г) при увеличении концентрации СО в 3 раза?
15. Константа скорости распада пенициллина при 36 оС равна 6·10-6 с-1, а при 41 оС она составляет 1,2·10-5 с-1. Вычислите температурный коэффициент реакции.
16.Женщина, «соблюдающая фигуру», съела вне плана в составе торта 180 г глюкозы. Считать, что глюкоза полностью окисляется в организме по уравнению:
С6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж)
Какое количество энергии получит организм пациентки? Какое время пациентка должна затратить на ручную стирку белья или окучивание грядок (расход энергии 543 кДж/ч), чтобы компенсировать излишества?
17.Мужчина, «следящий за фигурой», выпил на вечеринке водки в пересчете на абсолютный спирт 46 г этанола С2Н5ОН. Считать, что этанол полностью окисляется в организме по уравнению: С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж)
Какое количество энергии получит организм пациента? Какое время мужчина должен бегать трусцой (расход энергии 920 кДж/ч), чтобы компенсировать излишества?
18. Инспектор ГИБДД остановил водителя и по его внешнему виду заподозрил, что тот находится в состоянии алкогольного опьянения. Анализ, проведенный в токсикологической клинике, показал, что содержание этилового спирта в крови водителя превышает допустимую норму. Однако водитель утверждает, что алкогольных напитков не употреблял в течение нескольких дней. При выполнении профессиональных обязанностей ему приходится много времени проводить в условиях повышенной концентрации выхлопных газов и он считает, что в его организме спирт мог образоваться из CO2 и H2O. Рассчитать DGºреакции. Может ли происходить в организме человека самопроизвольное образование C2H5OH из CO2 и H2O?
19.Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция: СО2 (г)+Н2 (г)↔ СО(г)+Н2О (ж)? Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
20.Рассчитайте тепловой эффект реакции горения сероводорода.
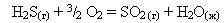
Возможно ли самопроизвольное протекании данного процесса при стандартных условиях?
Решение контрольного задания:
_____________________________________________________
_________________________________________________________________________________________________________
