П 6. Расчет энтропии химической реакции. Расчет энергии Гиббса.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
П 5. Энергетические эффекты химических процессов.
Термохимические расчеты. Расчет теплоты сгорания топлива.
Пример 1.Термохимическое уравнение реакции. Энтальпии образования вещества.
Напишите термохимическое уравнение реакции, которое отвечает энтальпии образования H2SO4(ж).
Решение.Химические уравнения реакций, в которых указаны агрегатные состояния веществ и тепловые эффекты, называются термохимическими уравнениями.
Стандартной энтальпией (теплотой) образования веществаназывается энтальпия образования 1 моля вещества из простых веществ, если все участники реакции находятся в стандартных состояниях (с.с. при 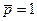 и
и 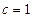 моль/л), (ΔfН0298 см.Приложение 2, [1]
моль/л), (ΔfН0298 см.Приложение 2, [1]
По определению, искомое уравнение должно состоять из исходных простых веществ, устойчивых в стандартном состоянии:
H2(г) + 2O2(г) + S(к) = H2SO4(ж) , ΔfН0298 H2SO4 = −811,3 кДж/моль.
Из табл. (Приложение 2, [1]).
Отрицательное значение энтальпии образования соединения указывает на то, что в результате образования этого соединения из простых веществ теплота выделяется.
Пример 2. Взаимосвязь изменения энтальпии и внутренней энергии в результате реакции.
Рассчитайте изменение внутренней энергии системы при изохорно-изотермическом протекании реакции
С(к) + СО2(г) = 2СО(г)
при с.с. и 298 К.
Решение. Внутренняя энергия системы U – одна из термодинамических функций состояния системы. Изменение внутренней энергии в результате какого-либо процесса (например, химической реакции) ΔrU равно тепловому эффекту этого процесса, протекающего в изохорно-изотермических условиях (QV,T ), если при этом не совершается никакой работы:
QV,T = - ΔrU .
Энтальпия Н – одна из термодинамических функций состояния системы.
Изменение энтальпии в результате какого-либо процесса (химической реакции) ΔrН равно тепловому эффекту этого процесса, протекающего в изобарно-изотермических условиях (Qp,T), когда единственным видом работы является работа расширения газа:
Qp,T = - ΔrHТ.
Изменение энтальпии и внутренней энергии в результате реакции связаны соотношением:
ΔrН =ΔrU + ∆νRT,
где ∆ν – разница между числом молей газообразных продуктов и числом молей газообразных исходных веществ.
Если ΔrН < 0, то процесс идет с выделением тепла в окружающую среду и реакция называется экзотермической; если ΔrН > 0, теплота в результате реакции поглощается и реакция называется эндотермической.
Согласно данным (Приложение 2, [1] ):
Вещество ΔfН0298,кДж/моль
С(графит) 0
СО2 (г) −393,5
СО (г) −110,5
Для расчета энтальпии химической реакции при с.с. и 298 К воспользуемся следствием из закона Гесса:
ΔrН0298= ∑νiΔf Н0298, продуктов − ∑νjΔf Н 0298, исх веществ ;
ΔrН0298 = 2ΔfН0298СОг − ΔfН0298Ск − ΔfН0298СО2г = 2(−110,5) – 0 – (−393,5) =
= 172,5 кДж. Так как ΔrН0298 > 0, данная реакция эндотермическая.
Изменение энтальпии и внутренней энергии в результате реакции связаны соотношением:
ΔrН =ΔrU + ∆νRT .
Тогда ∆rU0298 = ∆rH0298 – ∆νRT =
= 172,5 – 1·8,31·298·10−3 = 170,02 кДж. (Разница между числом молей газообразных продуктов и исходных веществ равна ∆ν = 2 − 1 = 1 моль).
Универсальная газовая постоянная R=8,31 Дж/моль.К.
Пример 3. Закон Гесса. Метод циклов.
Вычислите тепловой эффект образования NH3 из простых веществ при стандартном состоянии по тепловым эффектам реакций:
2H2 + O2 = 2H2O(ж);; Dr H01 = - 571,68 кДж (1)
4 NH3 + 3 O2 = 6 H2O(;ж) + 2 N2 ; Dr H02 = - 1530,28 кДж (2).
Решение. Закон Гесса: Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
Запишем уравнение реакции, тепловой эффект которой необходимо определить:
½N2 + 3/2Н2 = NH3 ; Dr H03 = Df H0NH3= ?;(3).
В уравнения (1) и (2) входят Н2О (ж) и О2, которые не входят в уравнение (3), поэтому, чтобы исключить их из уравнений (1) и (2), умножим уравнение (1) на 3 и вычтем из него ур (2):
6Н2 + 3О2 – 4NН3 – 3О2 = 6Н2О (ж) – 6Н2О (ж) – 2N2 (г) (4).
После преобразования уравнения (4) и деления его на 4 получаем искомое уравнение (3). Аналогичные действия проделаем с тепловыми эффектами:
(3DrH01– DrH02)/4 = DrH03. В результате получаем:
Dr H03 = [3(–571,68) – ( – 1530,28)] / 4 = – 46,19 (кДж);
т.е. ∆ f Н0 NH3 = – 46,19 кДж/моль.
Пример 4.Закон Гесса. Метод циклов.
Определите стандартный тепловой эффект реакции:
С(к) + СО2(г) = 2СО(г); (1),
если известны тепловые эффекты двух других реакций:
2С(к) + О2(г) = 2СО(г) ; ∆rH0298 = −221 кДж (2)
и
2СО(г) + О2(г) = 2СО2(г); ∆rH0298 = −566,1 кДж (3).
Решение.Закон Гесса: Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
Для того, чтобы получить уравнение реакции (1), нужно из уравнения реакции (2) вычесть уравнение реакции (3) и разделить полученное выражение на 2. Те же действия следует проделать и с величинами ∆rH0.
Имеем ∆rH01 = (∆rH02 − ∆rH03)/2 = [−221 – (−566,1)]/2 = 172,5 кДж.
Пример 5. Расчет стандартной энтальпии химической реакции при различных температурах.
Рассчитайте стандартный тепловой эффект изобарно-изотермической реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и при 1000 К , считая постоянными теплоемкости реагентов в данном температурном интервале.
Решение. Запишем значения стандартной энтальпии образования и стандартной теплоемкости веществ согласно данным (Приложение 2, [1] ):
Вещество ΔfН0298,кДж/моль С0р298, Дж/моль.К
С(графит) 0 8,54
СО2 (г) −393,5 37,41
СО (г) −110,5 29,14
Для расчета энтальпии химической реакции при с.с. и 298 К воспользуемся следствием из закона Гесса:
ΔrН0298= ∑νiΔf Н0298, продуктов − ∑νjΔf Н 0298, исх веществ ;
ΔrН0298 = 2ΔfН0298СОг − ΔfН0298Ск − ΔfН0298СО2г = 2(−110,5) – 0 – (−393,5) =
= 172,5 кДж. Так как ΔrН0298 > 0, данная реакция эндотермическая.
Зависимость энтальпии реакции от температуры в области 298 ÷Т, в которой нет фазовых переходов, в интегральном виде выражается уравнением Кирхгофа:
Т
∆rH0T = ∆rH0298 + ∫ ∆rС0pdT ,
298
где ∆rН0298 − стандартная энтальпия реакции при 298К; ∆rСp0 − изменение стандартной теплоемкости системы в ходе реакции.
Если пренебречь зависимостью Ср реагирующих веществ от Т, то есть
∆rС0p = const, то имеем приближение в виде:
∆rН0Т = ∆rН0298 + ∆rС0р(Т − 298) ,
рассчитать ∆С0р можно по справочным данным, как разность стандартных изобарных теплоемкостей продуктов и исходных веществ при 298 К.
Рассчитаем изменение теплоемкости системы в результате реакции:
∆rС0р = 2С0р298СОг – С0р298Ск – С0р298СО2г = 2(29,14) – 8,54 – 37,41 = 12,33 Дж/К.
По уравнению
∆rН0Т = ∆rН0298 + ∆rС0р(Т − 298)
рассчитаем энтальпию химической реакции при с.с. и 1000 К:
∆rН01000 = 172,5 + 12,33·10−3(1000 − 298) = 172,5 + 8,66 = 181,16 кДж.
Из расчетов следует, что при изменении температуры на 702 К увеличение теплового эффекта составляет всего около 5%.
Пример 6. Расчет тепла, выделенного в результате химической реакции.
Определите энтальпию процесса конденсации воды. Рассчитайте, сколько тепла выделится при образовании 1 м3 жидкой воды из пара при стандартных состояниях вещества.
Решение. Конденсация – это процесс перехода из газообразного состояния в жидкое, который относится к фазовым превращениям. Запишем уравнение конденсации для воды:
Н2О(г) = Н2О(ж).
Энтальпию этого превращения рассчитываем по следствию из закона Гесса, используя данные табл. (Приложение 2, [1]):
ΔrН0298= ∑νiΔf Н0298, продуктов − ∑νjΔf Н 0298, исх веществ ;
∆rН0298 = ∆fН0298Н2Ож – ∆fН0298Н2Ог = −285,84 – (−241,84) = −44 кДж.
Так как ΔrН0298 < 0, процесс конденсации экзотермический.
Энтальпии химической реакции ΔrН равна тепловому эффекту этого процесса, протекающего в изобарно-изотермических условиях (Qp,T):
Qp,T = - ΔrHТ.
Определим количество вещества Н2О, содержащееся в 1 м3. Так как плотность воды ρ = 1 г/см3, то масса 1м3 воды: m = ρV = 1·106 г.
Количество молей Н2О νН2О = m/MН2О = 106/18 = 5,56·104 моль.
Поскольку при конденсации 1 моля воды выделяется 44 кДж тепла, то при конденсации 5,56·104 молей выделится
Q = 44·5,56·104 = 2,45·106 кДж тепла.
Пример 7.Расчет удельной теплоты сгорания газового топлива.
Вычислить удельную теплоту сгорания газового топлива, содержащего 60% Н2 и 40% СН4, если известны теплоты сгорания газов: 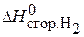 = –286 кДж/моль;
= –286 кДж/моль; 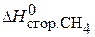 = –890 кДж/моль.
= –890 кДж/моль.
Решение. Термохимические уравнения процессов сгорания водорода и метана:
Н2(г) + ½О2(г) → Н2О(ж); 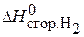 = –286 кДж/моль;
= –286 кДж/моль;
СН4(г) + 2О2(г) → СО2(г) + 2Н2О(ж) ; 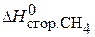 = –890 кДж/моль.
= –890 кДж/моль.
Теплота сгорания топлива может быть рассчитана по следствию из закона Гесса:
ΔrН0Т = ∑νiΔfНi0 продуктов − ∑νjΔfНj 0исх веществ .
Удельная теплота сгорания газа QТ равна количеству теплоты, выделяющейся при сгорании 1м3 газообразного вещества до образования высших оксидов.
По условию задачи 1м3 данного газового топлива содержит 600 л Н2 и 400 л СН4, что составляет соответственно 600/22,4 молей Н2 и 400/22,4 молей СН4. (использовали молярный объем газа при нормальных условиях 22,4 л/моль).
В соответствии с уравнением:
Qт = –DНсгор×(1000/22,4),
рассчитаем удельную теплоту сгорания газового топлива:
Qт = 286×(600/22,4) + 890×(400/22,4) = 7660,7 + 15892,8 = 23550 кДж/м3.
П 6. Расчет энтропии химической реакции. Расчет энергии Гиббса.
Определение термодинамической возможности самопроизвольного протекания химической реакции в заданном направлении. Определение температурной области самопроизвольного протекания химической реакции.
Пример 1.Расчет стандартной энтропии химической реакции при различных температурах.
Рассчитайте стандартную энтропию химической реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и при 1000 К, считая постоянными теплоемкости компонентов в рассматриваемом температурном интервале.
Решение. Энтропия S – функция состояния системы, которая служит мерой неупорядоченности этой системы, измеряется в Дж/(моль·К).
Согласно данным табл. (см. Приложение IV, [2]; Приложение 4, [3] ):
Вещество f S0298, Дж/(моль·K) С0р298, Дж/(моль·К)
С(графит) 5,74 8,54
СО2 (г) 213,68 37,41
СО (г) 197,54 29,14
Стандартная энтропия химической реакции при с.с. ( 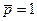 и
и 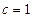 моль/л) и 298 К, обозначается ∆rS0298 и рассчитывается по уравнению (следствие из закона Гесса):
моль/л) и 298 К, обозначается ∆rS0298 и рассчитывается по уравнению (следствие из закона Гесса):
ΔrS0298 = ∑νi fS0298,i продуктов − ∑νj fS0298,j исх. веществ ,
где f S0298 - стандартная энтропия образования веществ при 298 К (см. Приложение IV, [2]; Приложение 4, [3] ); νi - стехиометрические коэффициенты уравнения химической реакции.
Рассчитаем:
ΔrS0298 = 2S0298,СОг − S0298,Ск − S0298,СО2г = 2(197,54) – 5,74 – 213,68 =
= 175,66 Дж/K.
То есть данная реакция при 298 К идет с увеличением энтропии, что и следовало ожидать, так как число молей газообразных веществ в результате реакции увеличивается.
Зависимость энтропии реакции от температуры в области 298 ÷Т, в которой нет фазовых переходов, в интегральном виде выражается уравнением
Т
∆rS0T = ∆rS0298 + ∫ (∆rС0p/Т)dT ,
298
где ∆rS0298 − стандартная энтропия реакции при 298 К; ∆rС0p − изменение суммарной стандартной теплоемкости системы в ходе реакции.
Рассчитаем изменение стандартной теплоемкости системы в результате реакции:
∆r С0 р= 2С0р 298СОг – С0р 298Ск – С0р 298СО2г = 2.(29,14)–8,54–37,41 =12,33 Дж/К.
Для многих реакций можно пренебречь зависимостью Ср реагирующих веществ от Т, то есть ∆rС0p = const. Тогда имеем приближение в виде:
∆rS0T = ∆rS0298 + ∆rС0р(lnТ − ln298).
По этому уравнению рассчитаем
∆rS01000 = 175,66 + 12,33ln(1000/298) = 175,66 + 14,93 = 190,59 Дж/К.
Как следует из расчетов, увеличение энтропии реакции, обусловленное ростом суммарной теплоемкости системы, при изменении температуры на 702 К составляет около 8,5%.
Пример 2. Расчет энергии Гиббса химической реакции при стандартном состоянии и различных температурах. Возможное направление самопроизвольного протекания процесса.
Рассчитайте стандартную энергию Гиббса химической реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и при 1000 К. Сделайте вывод о возможности самопроизвольного протекания этой реакции при указанных температурах и стандартных состояниях всех компонентов.
Решение.Направление любого процесса определяется соотношением энтальпийного ∆rН и энтропийного Т∆rS факторов реакции.
Энергия Гиббса,или свободная энергия G - функция состояния системы, учитывающая совместное влияние этих факторов, G = H – TS.
Однозначный критерий возможности самопроизвольного протекания реакции в прямом направлении в изобарно-изотермических условиях:
∆rGТ = (∆rHТ – T∆rSТ) < 0 .
1). Для начала, будем считать, чтоэнтальпия и энтропия реакции не зависят от температуры. В широком интервале температур в первом приближении можно считать неизменной величину стандартной теплоемкости веществ в ходе химической реакции ∆rС0p = 0 , тогда
∆rН0T = ∆rН0298 и ∆rS0T = ∆rS0298 .
Для расчета применим приближенную формулу расчета энергии Гиббса
∆rG0Т = ∆rH0298 − T∆rS0298 .
Используем данные, полученные в Примере 1. ( ΔrS0298 = 175,66 Дж/K) и в Примере 5. предыдущего практического занятия (ΔrН0298 = 172,5 кДж).
∆rG0298 = 172,5 – 298·175,66·10−3 = 120,15 кДж, то есть ∆rG0298> 0;
∆rG01000 = 172,5 – 1000·175,66·10−3 = −3,16 кДж, то есть ∆rG01000< 0.
Таким образом, при 298 К и стандартных состояниях веществ самопроизвольное протекание указанной реакции в прямом направлении невозможно (энтальпийный фактор не способствует самопроизвольному протеканию прямой реакции и определяет знак энергии Гиббса реакции при низких температурах). При высоких температурах определяющим становится энтропийный фактор реакции, он определяет отрицательное значение энергии Гиббса реакции при 1000 К и, следовательно, возможность самопроизвольного протекания реакции при этой температуре и стандартных состояниях компонентов.
2). Для более точного расчета ∆rG01000сначала рассчитаем изменение стандартной теплоемкости системы в ходе реакции:
∆r С0 р= 2С0р 298СОг – С0р 298Ск – С0р 298СО2г = 2.(29,14)–8,54–37,41 =12,33 Дж/К.
Значение стандартной ∆rG0Т для любой температуры Т можно в общем случае рассчитать с использованием справочных данных по уравнению:
Т Т
∆rG0Т = ∆rH0Т −T∆rS0Т = ∆rH0298 + ∫ ∆rС0pdT + Т∆rS0298 + Т ∫ (∆rС0p/T)dT .
298 298
Для многих реакций можно пренебречь зависимостью Ср реагирующих веществ от Т, то есть ∆rС0p = const. Тогда имеем приближение в виде:
∆rG0T = ∆rG0298 + ∆rС0р(Т − 298) - T. ∆rС0р(lnТ − ln298).
Для расчета ∆rG01000используем это приближение:
∆rG01000= ∆rG0298 + ∆rС0р(Т − 298) - T. ∆rС0р(lnТ − ln298) =
= 120150 +12,33. (1000-298) – 1000.12,33(ln1000 − ln298) =
= -9430 Дж = -9,43 кДж, то есть ∆rG01000< 0.
Как видно, имеется различие в значениях стандартной энергии Гиббса ∆rG0T, рассчитанной по разным методикам.
Пример 3. Определение температурной области самопроизвольного протекания реакции.
Определите температурную область самопроизвольного протекания реакции
С(к) + СО2(г) = 2СО(г)
при стандартных состояниях компонентов.
Решение. Реакция может протекать самопроизвольно при стандартных состояниях компонентов в определенной области температур, для которых ∆rG0Т < 0.Чтобы найти эту область температур нужно определить граничную температуру (температуру равновесия), при которой значение ∆rG0Т меняет знак, то есть необходимо решить неравенство относительно Т:
∆rG0Т = ∆rH0298 + ∫Т298∆rС0pdT + Т∆rS0298 + Т∫Т298(∆rС0p/T)dT < 0.
Если пренебречь зависимостью ∆rH0 и ∆rS0от температуры, то граничную температуру (температуру равновесия) можно определить из приближенного неравенства:
∆rG0Т = ∆rH0298 − T∆rS0298< 0.
Подставляя в это выражение значения ΔrН0298 = 172,5 кДж и
ΔrS0298 = 175,66 Дж/K, (см. Пример 3) , получаем:
∆rG0Т =(172,5 – Т·175,66·10−3) < 0.
Откуда Т > 982 К. Верхним пределом искомой температурной области является предел существования наименее устойчивого компонента реакции, который находится из справочных данных.
Вещество Температурный интервал, К
