Свойства воды как растворителя
вода – растворитель, самый распространенный в природе
свойства воды как растворителя:
- высокая диэлектрическая проницаемость - вода активно растворяет вещества с полярными молекулами
- образование водородных связей между частицами в-ва и молекулами воды
- низкая вязкость воды
свойства воды как растворителя определяются строением молекул воды
строение молекулы воды
 формула молекулы воды H2O
формула молекулы воды H2O
H -
\
О(II)-2 хим.связь одинарная полярная ковалентная, Ð105°
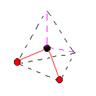
 / молекула имеет угловую форму _ -
/ молекула имеет угловую форму _ -
H+ -
молекула в виде диполя: 2 неподеленные е-пары атома кислорода образуют (-)полюс +
2 катиона водорода образуют (+)полюс +
диполи воды активно растворяют вещества с полярными молекулами:
полярные - молекулы неорганических веществ, имеющие или ионные связи, или полярные ковалентные связи
полярные - молекулы органических веществ, имеющие полярные функциональные группы
полярные молекулы имеют свойства диполей
электрический диполь - два точечных заряда, одинаковые по величине и противоположные по знаку,
находящиеся на расстоянии l друг от друга, которое называется плечом диполя
Р = q × l - электрический момент диполя
различают молекулы с постоянной полярностью – жесткие диполи, и
молекулы с непостоянной полярностью – индуцированные диполи
диполи воды вызывают электролитическую диссоциацию растворяемых в-в или распад в-в на ионы:
растворяемые в-ва должны иметь ионные или полярные ковалентные связи
вокруг частиц растворяемого в-ва диполи воды образуют гидратные оболочки
 гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва
гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва
ПР: HCl полярная ковалентная связь
в-во находится в растворенном виде,
в электрическом поле диполя H+Сl- диполи Н2О располагаются упорядоченно,
взаимодействие диполей Н+Cl- и упорядоченно расположенных диполей Н2О поляризует связь Н+-Cl- до ионной
взаимодействие диполей Н+-Сl- и упорядоченно расположенных диполей Н2О ослабляет связи Н+-Cl-,
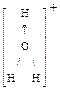 образуются ионы Cl-_и Н+ (свободно не существуют)
образуются ионы Cl-_и Н+ (свободно не существуют)
физическая фаза ®химическая фаза:
в электрическом поле ионов Н+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Сl- и ионы гидроксония Н3О+ (донорно-акцепторная связь)

NaCl ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и Cl- и диполей Н2О ослабляет связи Na+-Cl-,
образуются ионы Na+ и Cl- (одновременно идет растворение и диссоциация)
физическая фаза ®химическая фаза:
в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и Сl-

NaОН ионная связь, ионная кристаллическая решётка
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно,
взаимодействие ионов Na+ и ОН- и диполей Н2О ослабляет связи Na+-ОН-,
образуются ионы Na+ и ОН- (одновременно идет растворение и диссоциация)
физическая фаза ®химическая фаза:
в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно
® гидраты ионов Na+ и гидроксид-ионы ОН-
гидрофильное и гидрофобное взаимодействие веществ с водой
вещества по растворимости в воде делятся на гидрофильные и гидрофобные
- гидрофильные хорошо растворяются в воде
состоят из ионов и полярных молекул или молекул с полярными функциональными группами
варианты гидрофильного взаимодействия – ионно-дипольное ПР: растворение NaCl
диполь-дипольное ПР: растворение HCl
образование водородных связей ПР: растворение С2Н5ОН
- гидрофобные плохо растворяются в воде
состоят из неполярных молекул
гидрофобное взаимодействие – «отталкивание» молекул воды от молекулы в-ва
- дифильные, у которых молекулы имеют и гидрофильные, и гидрофобные группы
дифильные молекулы при растворении в воде деформируются так,
чтобы контакт с водой гидрофобных групп уменьшился, а контакт с водой гидрофильных групп увеличился
ПР: в воде белковые молекулы приобретают форму глобул
внутри глобул гидрофобные группы, снаружи глобул гидрофильные группы
влияние на растворимость природы компонентов, температуры и давления
факторы, влияющие на растворимость в-в:
- природа растворителя
одно в-во в разных растворителях растворяется по-разному
289) природа в-ва.полярные растворители и неполярные растворители.
различают полярные растворители и неполярные растворители
ПР: вода, спирт – полярные растворители
у полярных растворителей полярные молекулы
полярные растворители сильно поляризуются и имеют высокую диэлектрическую проницаемость e
в полярных растворителях хорошо растворяются в-ва ионной структуры с ионными связями и
молекулярной структуры с полярными ковалентными связями
в неполярных растворителях хорошо растворяются в-ва молекулярной структуры с неполярными ковалентными..
- природа в-ва
в одном растворителе разные в-ва растворяются по-разному
некоторые в-ва имеют низкую растворимость
ПР: твердые в-ва с прочной атомной кристаллической решеткой практически нерастворимы
в-ва с ионной и полярной ковалентной связью хорошо растворяются в полярных растворителях
в-ва с неполярной ковалентной связью плохо растворяются в полярных растворителях
ПР:
одна из причин высокой растворимости в-в – образование связей между частицами в-ва и растворителя
ПР: при растворении спирта в воде образуются водородные связи между молекулами воды и спирта
ПР: при растворении AgCl в водном растворе NH3 образуются комплексы [Ag(NH3)4]+
- температура и давление, присутствие в растворе других в-в..
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
внешние факторы – температура, давление, присутствие других в-в..
график зависимости растворимости от температуры – кривая растворимости..
растворимость твердых в-в в жидкостях
факторы, влияющие на растворимость твердых в-в в жидкостях:
- природа растворителя..
- природа твердого в-ва..
- температура и давление
если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье
если растворение эндотермический процесс –
при нагревании растворимость твердых в-в в жидкостях увеличивается
если растворение экзотермический процесс –
при нагревании растворимость твердых в-в в жидкостях уменьшается
объем системы при растворении твердых тел в жидкостях не меняется –
повышение давления не влияет на растворимость твердых в-в в жидкостях
- присутствие в растворе других в-в..
