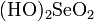Концентрированная серная кислота в обычных условиях пассивирует
некоторые металлы (Fe, Al, Cr, Co, Ni). Поэтому концентрированную сер-
ную кислоту перевозят в стальных цистернах.
Для серы известны кислоты и соли, содержащие в своем составе перок-
согруппу (О – О)2- . Такие кислоты называются пероксокислотами. К ним
относятся следующие кислоты серы: Н2SО5 пероксосерная кислота (моно
надсерная кислота) и H2S2O8 пероксодисерная кислота (надсерная кислота).
Обе кислоты – бесцветные кристаллические вещества, плавящиеся при
нагревании с разложением при температуре 47 о
С (Н2SО5) и 65 оС (H2S2O8).
2 Н2SО5 = 2 Н2SО4 + О2
Водород, связанный с пероксогруппой в Н2SО5 , на металл не замеща-
ется, поэтому для этой кислоты известны только кислые соли КНSО5 (гид-
ропероксомоносульфат калия). Пероксосерные кислоты подвергаются не-
обратимому гидролизу. Гидролиз пероксодисерной кислоты протекает в
две стадии:
H2S2O8 + H2O = Н2SО5 + Н2SО4
Н2SО5 + Н2О <=> Н2SО4 + Н2О2
H2S2O8 + 2 Н2О = Н2О2 + 2 Н2SО4
Это свойство надсерной кислоты используют в промышленном произ-
водстве Н2О2. Ниже 0 о С водные растворы этих кислот устойчивы. Все со-
ли пероксосерных кислот растворимы в воде. Пероксосерные кислоты и их
соли – сильные окислители. В сильнокислой среде они обугливают бумагу,
Н2SО5 H2S2O8 сахар и даже парафин. Пероксодисульфат (или персульфат) аммония(NH4)2S2O8 способен окислить Mn2+ до MnO4-, а Сr3+до Сr2О7 2-
5(NH4)2S2O8 + 2MnSO4 + 8Н2О = 5(NH4)2SO4 + 2HMnO4 + 7Н2SО4
3(NH4)2S2O8 + Сr2(SO4)3 + 7Н2О = 3(NH4)2SO4 + H2Сr2О7 + 6Н2SО4
Стандартный электродный потенциал системы:
S2O8 2- + 2ē = 2 SO4 2- Е˚ = 2,01 В
имеет очень высокое значение, поэтому окислительную функцию по отно-
шению к сульфат-ионам может выполнять электрический ток. Для синтеза
H2S2O8 применяют электрохимический метод – электролиз концентриро-
ванных водных растворов Н2SО4 или KHSO4:
K: 2H+ + 2 ē = H2
A: 2SO4 2- - 2 ē = S2O8 2-
Кислоту Н2SО5 получают при действии 100 % пероксида водорода на
пероксодисерную кислоту:
H2S2O8 + Н2О2 = 2 Н2SО5
Вопрос №13
Селеновая и теллуровая кислоты – бесцветные кристаллические вещест-
ва, хорошо растворимые в воде. Свободная теллуровая кислота обычно вы-
деляется в виде кристаллогидрата H2ТeО4. 2Н2О или H6ТeО6. В ортотеллу-
ровой кислоте атомы водорода могут частично или полностью замещаться
атомами металлов (К6ТeО6). Селеновая кислота по силе близка к серной
кислоте, водный раствор теллуровой кислоты проявляет свойства слабой
кислоты.
Селе́новая кислота́ — неорганическая кислота, состоящая из катиона водорода и аниона селената (SeO42-). Химическая формула . 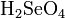
Так как она является кислородсодержащей кислотой, то ее структурную формулу более правильно можно было бы описать формулой