Взаємний вплив атомів в молекулі толуену.Хімічні властивості толуену
Так як група СН3 є замісником першого роду,то вона орієнтує наступний замісник в орто- і пара-положення, крім того замісники першого роду, що знаходяться в бензольному кільці, полегшують вступ наступного замісника. Алкільна група проявляє +І-ефект. У зв”язках С─Н частковий від”ємний заряд несе на собі атом вуглецю: частина накопиченої енергії передається в ядро і зосереджується в орто- і пара-положення.
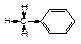 δ─ δ+
δ─ δ+
δ─ δ+
δ─ δ+
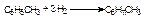 Хімічні властивості:
Хімічні властивості:
1)гідрування
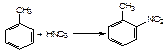 2) найбільш характерні реакції електрофільного заміщення в орто- і пара-положення (сульфування H2SO4, алкілювання R─Hal ( в присутності кислот Люїса), ацилювання, галогенування, нітрування):
2) найбільш характерні реакції електрофільного заміщення в орто- і пара-положення (сульфування H2SO4, алкілювання R─Hal ( в присутності кислот Люїса), ацилювання, галогенування, нітрування):
3) не тільки метильна група впливає на бензольне кільце, а і кільце впливає на метильну групу, внаслідок чого водні стають рухливіщі і можуть за певних умов заміщуватись:
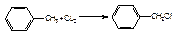 |
hν
─HCl
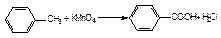 реакція окиснення:
реакція окиснення:
нуклеофільне замішення не характерне для толуену.
О.Х.
15.Способи утворення зв”язку С─Hal
1.Замішення атому водню:
А) в алканах заміщення відбувається за радикальним механізмом. Швидкість реакції знижується в ряду:
F >Cl >Br >J. Найлегше заміщується третинний атом вуглецю. СН3─СН3+Cl2 => CH3─CH2J+HJ
Б) в алкенах заміщення може відбуватись при високотемпературному хлоруванні (аномальне хлорування):
СН2=СН2─СН3+СІ2 => СН2=СН─СН2СІ+НСІ
2.Приєднання:
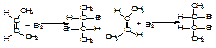 А)приєднання до алкенів галогену. фтор реагує з займанням, хлор легко вступає в реакцію приєднання на світлі з вибухом, бромування вимагає нагрівання йодування здійснюється важко. Приєднання залежить від природи алкену:
А)приєднання до алкенів галогену. фтор реагує з займанням, хлор легко вступає в реакцію приєднання на світлі з вибухом, бромування вимагає нагрівання йодування здійснюється важко. Приєднання залежить від природи алкену:
Б)приєднання до алкену галагеноводню.
СН2=CH2+HBr => CH2Br─CH3
зміна реакційної здатності галогеноводнів відносно алкенів зменшується в ряду: HJ >HBr >HCl >HF. Приєднання відбувається за правилом Марковнікова: водень приєднується до найбільш гідрогенізованого атому вуглецю.
Електрофільне приєднання проходить через низку стадій: утворення π-комплексу (іонна пара), яка перетворюється в карбкатіон (σ-комплекс), утворення галогенпохідного.
В)приєднання галогену і галогеноводню до алкадієнів.

 Приєднання за йонним механізмом в положення 1,2- або 1,4- залежить від температури, від часу реакції і природи галогену. Механізм реакції подібний до відповідного механізму для алкенів. CH2Br─CHBr─CH=CH2
Приєднання за йонним механізмом в положення 1,2- або 1,4- залежить від температури, від часу реакції і природи галогену. Механізм реакції подібний до відповідного механізму для алкенів. CH2Br─CHBr─CH=CH2
 СН2=СН─СН=СН2+Br2
СН2=СН─СН=СН2+Br2
 CH2Br─CH=CH─CH2Br
CH2Br─CH=CH─CH2Br
Г)приєднання галогену та галогеноводню до алкінів
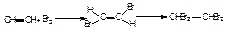 Приєднання відбувається у дві стадії, які відрізняються між собою швидкостями. При цьму виникає суміш цис- і транс- адуктів.
Приєднання відбувається у дві стадії, які відрізняються між собою швидкостями. При цьму виникає суміш цис- і транс- адуктів.
Ацетилен 1,2-диброметен 1,1,2,2-тетра
брометен
3.Заміщення функціональних груп галогенами (найчастіше гідроксильну групу в спиртах):
СН3СН2ОН+КBr+H2SO4 => CH3CH2Br+KHSO4+H2O
О.Х.
