Стандартная энтальпия образования вещества, ΔН°298(АВ) – это энтальпия реакции образования 1 моль этого вещества из простых веществ в стандартных условиях
Значения ΔН°298 приводятся в таблицах. Для простых веществ (Н2, О2, С и т.д.) значения ΔН°298 приняты равными нулю.
 Например, ΔН°298 (Н2О) = -286 кДж/моль означает, что при образовании 1 моль воды в стандартных условиях по реакции Н2 (Г) + ½ О2 (Г) Н2О(Ж) выделяется 286 кДж тепла.
Например, ΔН°298 (Н2О) = -286 кДж/моль означает, что при образовании 1 моль воды в стандартных условиях по реакции Н2 (Г) + ½ О2 (Г) Н2О(Ж) выделяется 286 кДж тепла.
Таким образом, для химии практическая ценность первого начала термодинамики заключается в том, что она позволяет рассчитывать тепловые эффекты реакций.
2.3 Закон Гесса и следствия из него
Исторически сложилось так, что энтальпию реакции научились рассчитывать ещё до того, как было сформулировано первое начало термодинамики. Для этого использовали закон Гесса (1840) и его следствия (уравнение 4 и 5), которые являются, фактически, математическими выражениями первого начала.
Закон Гесса
|

 Энтальпия реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода, т.е. не зависит от числа промежуточных стадий.
Энтальпия реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода, т.е. не зависит от числа промежуточных стадий.
|

|
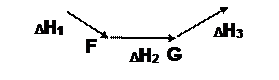 |
 ΔН= ΔН1+ ΔН2+ … ΔНi (5)
ΔН= ΔН1+ ΔН2+ … ΔНi (5)
Если вещества А и В превращаются в продукты С и Д. в одну или несколько стадий, то энтальпия этого перехода всегда одна и та же и равна ΔН, которая для многостадийных реакций складывается из энтальпий отдельных стадий. Закон Гесса позволяет рассчитывать энтальпии таких процессов, которые невозможно осуществить.
Пример 1. Рассчитать тепловой эффект реакции получения угарного газа окислением углерода, если известны энтальпии реакций
 С(Т) + О2 (Г) СО2 (Г) ΔН1 = -393 кДж
С(Т) + О2 (Г) СО2 (Г) ΔН1 = -393 кДж
 2СО (Г) + О2 (Г) 2СО2 (Г) ΔН2 = -282 кДж
2СО (Г) + О2 (Г) 2СО2 (Г) ΔН2 = -282 кДж
|


 С(Т) + О2 (Г) СО2 (Г)
С(Т) + О2 (Г) СО2 (Г)
| |||
| |||
СО (Г)
ΔН1= ΔН + ΔН2
ΔН = ΔН1 – ΔН2 = - 393 – (-282) = -111 кДж/моль
Таким образом, с помощью закона Гесса можно рассчитать энтальпию реакции образования угарного газа (СО), которую нельзя экспериментально определить из-за быстрого одновременного образования углекислого газа.
1-е следствие из закона Гесса


 Энтальпия прямой реакции равна энтальпии обратной реакции с противоположным знаком.
Энтальпия прямой реакции равна энтальпии обратной реакции с противоположным знаком.
ΔН = - ΔН (6)
Первое следствие можно использовать для сравнения устойчивости веществ, например, лекарственных препаратов при хранении. Так, если для препаратов АВ и СД стандартные энтальпии их образования имеют следующие значения
 А + В АВ ΔН°298 (АВ) = -100 кДж/моль
А + В АВ ΔН°298 (АВ) = -100 кДж/моль
 С + Д СД ΔН°298 (СД) = -300 кДж/моль,
С + Д СД ΔН°298 (СД) = -300 кДж/моль,
то обратная реакция их разложения идёт с поглощением тепла. Для препарата СД требуется больше затрат энергии, следовательно, оно более устойчиво.
2-е следствие из закона Гесса (приведено ранее, уравнение 4)
Энтальпия реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
 ΔН °р-ии = Σ i ΔН°298 продуктов – Σ i ΔН°298 исх. в-в
ΔН °р-ии = Σ i ΔН°298 продуктов – Σ i ΔН°298 исх. в-в
Пример 2 Рассчитать энтальпию реакции
 С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
Решение Выпишем из таблицы значения стандартных энтальпий образования всех веществ (ΔН°298) и запишем их под формулой каждого вещества в уравнении реакции
 С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
ΔН°298, кДж/моль -84,7 0 -74,8
Используя уравнение (4), рассчитаем тепловой эффект данной реакции
ΔН°р-ии = 2ΔН° (СН4) – [ΔН° (С2Н6) + ΔН° (Н2)]
ΔН°р-ии = 2∙(-74,8) – ( -84,7 + 0) = - 64,9 кДж /моль
Ответ: ΔН°р-ии < 0, реакция экзотермическая.
2.4. Медико-биологическое значение первого начала термодинамики
Закон сохранения энергии для живых организмов можно сформулировать так:
