Стандартная энергия Гиббса образования простых веществ условно принимается равной нулю
В справочниках обычно приводятся значения стандартных энергий Гиббса образования вещества при 298 К. Зная величины 𝛥Н и 𝛥S, можно рассчитать значение 𝛥G при других температурах и, соответственно, предсказать возможность или невозможность самопроизвольного течения реакции.
Энергия Гиббcа является функцией состояния системы. Поэтому её изменение в ходе той или иной химической реакции зависит только от природы, физического или агрегатного состояния исходных веществ и продуктов реакции, их количества и не зависит от промежуточных стадий реакции или от того, каким путем данная реакционная система достигла конечного состояния, т.е.
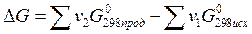 (1.29)
(1.29)
При суммировании обязательно учитывается число молей (v) всех участвующих веществ.
Пример 1. Вычислить 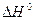 реакции, на основании стандартных теплот образования:
реакции, на основании стандартных теплот образования:
2Mg (к.) + CO2 (г.) = 2MgO (к.) + C (графит).
Решение. Используя стандартные энтальпии образования СО2 и MgO равны соответственно -393,5 и -601,8 кДж/моль (напомним, что стандартные энтальпии образования простых веществ равны нулю). Отсюда для стандартной энтальпии реакции находим:
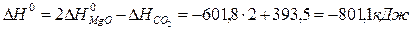
Пример 2. На основании стандартных теплот образования и абсолютных стандартных энтропий вещества вычислите 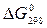 реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г)
Решение. 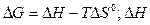 и
и 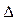 S – функции состояния, поэтому
S – функции состояния, поэтому
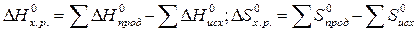
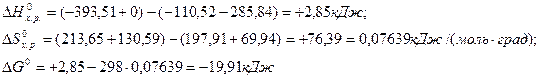
Пример 3. Восстановление Fe2O3 водородом протекает по уравнению




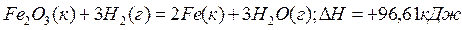
Возможна ли эта реакция при стандартных условиях, если изменение энтропии 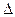 S=0,1387 кДж/(моль/град)? При какой температуре начнется восстановление Fe2O3?
S=0,1387 кДж/(моль/град)? При какой температуре начнется восстановление Fe2O3?
Решение. 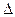 G0 реакции
G0 реакции 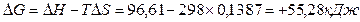 . Так как
. Так как 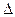 G>0, то реакция при стандартных условиях невозможна; наоборот при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой
G>0, то реакция при стандартных условиях невозможна; наоборот при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой 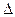 G=0:
G=0:
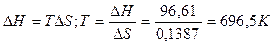
Следовательно, при температуре 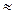 696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
121. Вычислите энтальпию образования хлорида меди, если известно, что при образовании 8,10 г этой соли выделилось 13,39 кДж тепла. Ответ: 222,24 (кДж/моль).
122. Вычислите теплоту образования оксида железа, исходя из уравнения 8Al + 3Fe3O4 = 4Al2O3 + 9Fe, DH0 = -3326 кДж.Энтальпия образования Al2O3 = 1669 кДж/моль. Ответ: -1116,7 (кДж/моль).
123. Вычислите энтальпию перехода графита в алмаз, если известно, что энтальпия образования CO2 из графита равна - 393,5 кДж/моль, а из алмаза - 395,4 кДж/моль. Ответ: 2,1 (кДж/моль).
124. Вычислите изменение энтропии в реакции горения этана: C2H4(Г) + 3O2(Г) = 2CO2(Г) + 2H2O(Г). Ответ: -29,80 кДж/(моль×К).
125. Возможна или не возможна в стандартных условиях реакция. 4HCl + O2 = 2H2O + 2Cl2. Ответ обосновать.
126. При какой температуре наступит равновесие в системе BaO(кр.) + 0,5 O2(Г) D BaO2(кр.), если DH0х.р. = -81,51 кДж, а DS0х.р. = -0,11 кДж×К? Ответ: 458,90С.
127. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС13 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите DH. Ответ: -111,4 (кДж/моль).
128. Вычислите энтальпию образования хлорида меди, если известно, что при образовании 8,10 г этой соли выделилось 13,39 кДж тепла. Ответ: 222,24 (кДж/моль).
129. Реакция горения этана выражается термохимическим уравнением: C2H6(г) + 3½O2 = 2 CO2(г) + 3H2O(ж); DHх.р = -1559,87 кДж.Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж). Ответ: -84,67 (кДж/моль).
130. Реакция горения этилового спирта выражается термохимическим уравнением: С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж); DН = ?Вычислите тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования С2Н5ОН(ж) равна +42,36 кДж и известны теплоты образования: С2Н5ОН(г); СО2(г); Н2О(ж). Ответ: -1366,87 (кДж/моль).
131. В каком состоянии энтропия 1 моль вещества больше: в кристаллическом или в парообразном при той же температуре? Ответ обосновать.
132. Прямая или обратная реакция будет протекать при стандартных условиях в системе: СН4(г) + СО2(г) 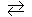 2СО(г) + 2Н2(г). Ответ обосновать.
2СО(г) + 2Н2(г). Ответ обосновать.
133. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ вычислите DGо298 реакции, протекающей по уравнению:СО(г) + Н2О(ж) = СО2(г) + Н2(г). Ответ: -19,91 (кДж/моль).
134. Реакция восстановления Fe2O3 водородом протекает по уравнению: Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2О(г); DН = +96,61 кДж.Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS = 0,1387 кДж/(моль×К)? При какой температуре начнется восстановление Fe2O3? Ответ: 695,5 К.
135. Вычислите DНo, DSo и DGoT реакции, протекающей по уравнению: Fe2O3(к) + 3С = 2Fe + 3СО. Возможна ли реакция восстановления Fe2O3 углеродом при температурах 500 и 1000 К? Ответ: DНo=490,54 (кДж/моль), DSo= 541,1 кДж/(мольК), DGo500 = 219,99 (кДж/моль), DGo1000 = - 50,56 (кДж/моль).
136. Пользуясь справочными данными, а) рассчитать DH°298реакции: CH4(г) + CO2(г) = 2CO(г) + 2 H2(г), если прореагировало 10 л метана, б) Определить направление протекания данной реакции при Т = 798 К (принять Dср= const). Ответ: а) 101,43 (кДж/моль), б) -466,2 (кДж/моль).
137. Определите количество теплоты, выделяющейся при гашении 100 кг извести водой при 25°С, если известны стандартные теплоты образования веществ, участвующих в химической реакции: ∆Н°f CaO (к) = -635,1 кДж/моль; ∆Н°f Н2О (ж) = -285,84 кДж/моль; ∆Н°f Са(ОН)2 = -986,2 кДж/моль. Ответ: 116536 (кДж/моль)
138. Вычислите изменение энергии Гиббса в химической реакции по значениям теплот образования и энтропий реагирующих веществ и продуктов реакции. Возможна ли данная реакция? NH3 (г) + НСl (г) = NH4Cl (к). Ответ: -92.08 (кДж/моль)
139. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2(Г) + СО2(Г) = СО(Г) + Н2О(Ж), Н0х.р. = -2,85 кДж. Ответ обосновать.
140. Вычислить ∆G для реакции CaCO3(K) = CaO(K) + CO2(Г) при 250С. Ответ: 129,1 (кДж/моль)
141. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: CaO, FeO, CuO? Ответ обосновать.
142. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: PbO, Fe2O3, Cr2O3? Ответ обосновать.
143. Указать знаки ∆Н и ∆S для процессов: а) испарение воды при 1000С при парциальном давлении паров воды 760 мм. Т. Ст., б) кристаллизация воды. Ответ обосновать.
144. Можно ли использовать при стандартных условиях нижеприведенную реакцию для получения аммиака: NH4Cl(K) + NaOH(K) = NaCl + H2O + NH3. Ответ обосновать.
145. Вычислить ∆G для реакции CaCO3(K) = CaO(K) + CO2(Г) при 15000С. Ответ: -122,01 (кДж/моль)
146. При сгорании 16 г магния выделилось 400,8 кДж. Определить энтальпию образования MgO(к.). Ответ: – 601,2 (кДж/моль)
147. Определите энтальпию реакции B2O3(к.) + 3 Mg(к.) = 2 B(к.) + 3 MgO(к.), DНреак = х кДж, если энтальпии образования B2O3(к.) и MgO(к.) равны соответственно –1272,8 и –601,2 кДж/моль. Ответ: – 530,8 кДж/моль
148. Определить стандартную энтальпию сгорания метана, если стандартные энтальпии образования CH4(г.), CO2(г.) и H2O(ж.) равны соответственно –74,8; –393,5 и –285,8 кДж/моль. Ответ: – 890,3 кДж/моль
149. Пользуясь данными справочника, определить, может ли при стандартной температуре самопроизвольно протекать реакция Fe2O3(к.) + H2(г.) = 2 FeO(к.) + H2O(г.)? Ответ обосновать.
150. Определите, возможно липри95oС самопроизвольноепротекание процесса Na2O(т) + H2O(ж) → 2NaOH(т). Ответ обоснуйте,рассчитав величину изменения энергии Гиббса приданной температуре. Ответ: ΔGo = –147,3 кДж.
КОНТРОЛЬНАЯ РАБОТА № 2
