Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Задания с комментариями и решениями
Пример 17. Объем сероводорода (н.у.), образующегося при действии избытка серной кислоты на 35,2 г сульфида железа(II), равен ________ л.
Ответ:__________ (Запишите число с точностью до сотых.)
Начать решение задачи следует с составления уравнения реакции:
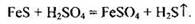
Рассчитаем количество вещества сульфида железа:
n(FeS) = 35,2/88 = 0,4 моль.
В соответствии с уравнением реакции сероводорода образуется такое же количество вещества, как и сульфида железа:
n(H2S) = n(FeS) = 0,4 моль (по уравнению реакции).
Следовательно, объем H2S составит 0,4 ∙ 22,4 = 8,96 л.
Ответ: 8,96
Пример 18. При сгорании 140 г железа в 112 л (н. у.) хлора образуется хлорид железа (III) количеством вещества _______ моль.
Ответ: ____________ (Запишите число с точностью до десятых.)
Задача на расчет массы продукта реакции, если одно из исходных веществ взято (дано) в избытке.
Составляем уравнение реакции:
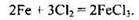
Находим количество вещества (моль) железа и хлора:
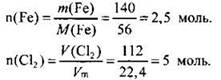
В соответствии с коэффициентами в уравнении реакции их количества должны соотноситься как 2 : 3. Делаем вывод о том, что хлор дан в избытке. Расчет будем вести по железу:
n(Fe) = n(FeCl3) = 2,5 моль.
Ответ: 2,5
Пример 19. 32,15 г алюминия растворили в избытке водного раствора едкого натра. Рассчитайте объем (н.у.) выделившегося в результате этой реакции газа.
Ответ:____________ (Запишите число с точностью до сотых.)
При решении этой задачи следует обратить внимание на правильную запись уравнения реакции. В растворе щелочи алюминий вытесняет из воды водород, образуя комплексную соль - гидроксоалюминат натрия:
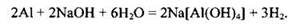
Количество моль алюминия, который вступает в реакцию:
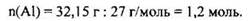
Согласно уравнению реакции
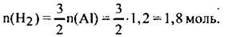
Объем выделившегося водорода
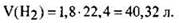
Ответ: 40,32
Задания для самостоятельной работы
61. При растворении карбоната натрия в избытке соляной кислоты выделилось 4,48 л (н.у.) газа. Масса карбоната натрия равна _______ г.
Ответ:_________ (Запишите число с точностью до десятых.)
62. При растворении оксида меди(II) в избытке серной кислоты образовалась соль массой 40 г. Масса оксида меди равна _______ г.
Ответ:_________ (Запишите число с точностью до целых.)
63. Для полного восстановления железной окалины израсходовано 896 л (н.у.) водорода. При этом получено железо массой _______ г.
Ответ:___________ (Запишите число с точностью до целых.)
64. Масса осадка, образовавшегося при сливании раствора, содержащего 52 г хлорида бария, и избытка раствора сульфата натрия, равна _______ г.
Ответ:___________ (Запишите число с точностью до сотых.)
65. Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2, равна _______ г.
Ответ:___________ (Запишите число с точностью до целых.)
66. При растворении карбоната натрия в избытке соляной кислоты выделилось 2,24 л (н.у.) газа. Масса карбоната натрия равна _______ г.
Ответ:___________ (Запишите число с точностью до десятых.)
67. Объём (н.у.) оксида серы (IV), который образуется при обжиге 0,2 моль сульфида цинка равен _______ л.
Ответ:___________ (Запишите число с точностью до сотых.)
68. В результате реакции алюминия с соляной кислотой образовалось 0,4 моль соли. Объём (н.у.) водорода, который выделился при этом равен _______ л.
Ответ:___________ (Запишите число с точностью до сотых.)
69. При взаимодействии 32 г карбида кальция с избытком воды образуется ацетилен, объём (н.у.) которого равен _______ л.
Ответ:___________ (Запишите число с точностью до десятых.)
70. При полном термическом разложении 10,1 г нитрата калия образуется газ, объём (н.у.) которого равен _______ л.
Ответ:___________ _(3апишите число с точностью до сотых.)
1.4.7. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси), если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного. Расчеты массовой доли (массы) химического соединения в смеси
Задания с комментариями и решениями
Пример 20. Сколько литров хлора (н.у.) выделится, если к 200 мл 35%-ной соляной кислоты (плотностью 1,17 г/мл) добавить при нагревании 26,1 г оксида марганца(IV)? Сколько граммов гидроксида натрия в холодном растворе прореагирует с этим количеством хлора? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
В соответствии с условием задачи происходят две химические реакции, которые следует записать
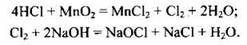
Далее необходимо провести расчет количества вещества хлороводорода:
n(НСl) = 200 ∙ 1,17 ∙ 0,35/36,5 = 2,24 моль.
Рассчитываем количество вещества оксида марганца, участвующего в реакции:
n(MnO2) = 26,1/87 = 0,3 моль.
Из уравнения реакции видно, что соляная кислота взята в избытке, поэтому расчет объема хлора ведем по оксиду марганца (IV).
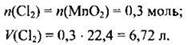
Остается определить массу гидроксида натрия, которая прореагирует с 6,72 л хлора:
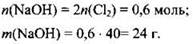
Пример 21. Углекислый газ объёмом 5,6 л (н.у.) пропустили через 164 мл 20%-ного раствора гидроксида натрия (ρ = 1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
Взаимодействие углекислого газа с гидроксидом натрия может привести к образованию как кислой, так и средней солей. Запишем уравнения этих реакций:
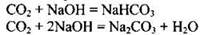
Чтобы определить какая из солей образуется, надо узнать соотношение количества вещества щелочи и углекислого газа:
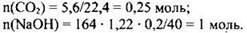
Щелочь дана в избытке, значит, образуется средняя соль.
Количество образовавшейся соли равно количеству углекислого газа в соответствии с уравнением реакции:
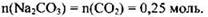
Определим массу образовавшейся соли:
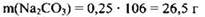
В полученном растворе кроме средней соли будет присутствовать непрореагировавшая щелочь. Определим её массу:
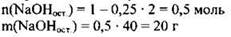
Вычислим массу получившегося раствора. Рекомендуем прочитать вновь условие задачи, чтобы «увидеть» массы каких компонентов составят массу получившегося раствора. Это будут масса углекислого газа и масса раствора щелочи:
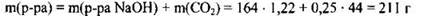
Определяем массовые доли веществ в растворе:
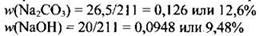
Ответ: w(Na2CO3) = 12,6%, w(NaOH) = 9,48%.
Пример 22. Смесь магниевых и цинковых опилок обработали избытком разбавленной серной кислоты, при этом выделилось 22,4 л (н.у.) водорода. Если такую же массу смеси обработать избытком раствора гидроксида натрия, то выделится 13,44 л (н.у.) водорода. Рассчитайте массовую долю магния в исходной смеси.
Составим уравнения описанных реакций. Учтём, что как магний, так и цинк взаимодействуют с кислотой, а со щелочью реагирует только цинк:
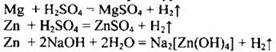
Зная объём водорода, выделившегося в реакции цинка со щелочью, можем определить количество вещества и массу цинка:
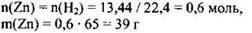
Общее количество вещества водорода, выделившегося в реакции металлов с кислотой равно n(Н2) = 22,4/22,4 = 1 моль.
В реакции с цинком выделится водород количеством вещества n(Zn) = n(Н2) = 0,6 моль, значит 1 - 0,6 = 0,4 моль водорода вытеснит магний. Следовательно, количество вещества магния n(Mg) = n(Н2) = 0,4 моль.
Масса магния m(Mg) = 0,4 ∙ 24 = 9,6 г.
Рассчитаем массовую долю магния в исходной смеси:
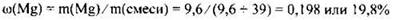
Ответ: ω(Mg) = 19,8%
Задания для самостоятельной работы
71. К раствору, полученному при добавлении 24 г гидрида натрия к 1 л воды, прилили 100 мл 30%- ного раствора азотной кислоты (ρ = 1,18 г/мл). Определите массовые доли веществ в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
72. Карбонат магния массой 8,4 г растворили в 250 мл раствора серной кислоты (ρ = 1,08 г/мл) с массовой долей 15%. Вычислите массовую долю сульфата магния в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
73. Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объем собранного газа. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
74. Карбид кальция массой 6,4 г растворили в 87 мл бромоводородной кислоты (ρ = 1,12 г/мл) с массовой долей 20%. Какова массовая доля бромоводорода в образовавшемся растворе? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
75. Медь, выделившаяся в результате реакции 2,6 г цинка с 160 г 5%-ного раствора сульфата меди (II), полностью прореагировала с 20 мл разбавленной азотной кислоты (ρ = 1,055 г/мл). Определите массовую долю нитрата меди (II) в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
76. В раствор, содержащий 51 г нитрата серебра, прилили 18,25 г 20%-ного раствора соляной кислоты. Какая масса 26%-ного раствора хлорида натрия потребуется для полного осаждения ионов серебра из оставшегося раствора нитрата серебра? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
77. Нитрит калия массой 8,5 г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объем (н. у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
78. В 15%-ном растворе серной кислоты массой 300 г растворили карбид алюминия. Выделившийся при этом метан занял объём 2,24 л (н.у.). Рассчитайте массовую долю серной кислоты в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
79. Какую массу оксида серы(VI) следует добавить к 500 г 20%-ного раствора серной кислоты, чтобы увеличить её массовую долю до 40%? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
80. Хлорид фосфора(V) массой 4,17 г полностью прореагировал с водой. Какой объём раствора гидроксида калия с массовой долей 10% (плотностью 1,07 г/мл) необходим для полной нейтрализации полученного раствора? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
81. При растворении пероксида лития Li2O2в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.у.) может быть поглощён получившейся щёлочью? В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
82. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
83. Смесь кремния и алюминия определённой массы обработали избытком разбавленной серной кислоты. При этом выделилось 0,336 л (н.у.) газа. Если эту же смесь обработать избытком раствора гидроксида натрия, то выделится 0,672 л (н.у.) газа. Рассчитайте массовую долю алюминия в исходной смеси. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
84. Оксид алюминия массой 10,2 г сплавили с карбонатом натрия массой 21,2 г. Весь плав растворили в 250 мл хлороводородной кислоты (плотностью 1,10 г/мл) с массовой долей 20%. Рассчитайте массовую долю хлороводорода в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
