Механизм действия ферментов
 Ферменты обладают рядом каталитических свойств:
Ферменты обладают рядом каталитических свойств:
1) Не смещают каталитическое равновесие
2) Не расходуются в процессе реакции
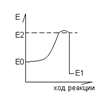
3) Катализирую только термодинамически реальные реакции. Такими реакциями являются те в которых сходный энергетический запас молекул больше чем финальный.
Разница между Е этого порога и исходным есть энергия активации. Скорость ферментативных реакций определяется энергией активации и другими факторами.
Константа скорости химической реакции определяется по уравнению:
К=P*Z*e- (Ea/RT)
К - константа скорости
Р – пространственный стерический коэффициент
Z – число взаимодействующих молекул
Еа – энергия активации
R – газовая постоянная
Т – универсальная температура
е – основание натуральных логарифмов
В этом уравнении z, е, RT – постоянные величины. Р и Еа переменные. Причем между скоростью реакции (К) и давлением зависимость прямая. К и Еа – обратная и степенная зависимость. Чем ниже Еа тем выше скорость реакции.
Механизм действия ферментов сводится к увеличению ферментами стерического коэффициента и уменьшению энергии активации.
Энергия активации.
Разложение Н2О2 без ферментов и катализаторов – 18 г/ккал на моль, если используется давление и температура то 12 000 ккал/моль. Если используется каталаза, то Еа=2 000 калл/моль.
Уменьшение Еа происходит в результате образования промежуточных фермент-субстратных комплексов. F+S <=> FS-комплекс → F + продукты реакции. Впервые возможность образование ферментных комплексов была доказана Михаэлисом, Ментеном. В последствии многие комплексы были выделены благодаря высокой избирательности ферментов при взаимодействии с субстратом: тория ключа и замка Фишера. Согласно теории фермент взаимодействует с субстратом абсолютно соответствуют друг другу (комплиментарно) как ключ и замок. Теория объясняла специфичность ферментов, но не раскрывала механизмы воздействия на субстрат и поэтому возникла теории индуцированного соответствия фермента и субстрата. Теория Кошланда (резиновой перчатки) ее суть активный центр фермента сформирован и содержит все функциональные группы еще до взаимодействия с субстратом. Однако эти функциональные группы находятся в неактивном состоянии. В момент присоединения с субстратом субстрат индуцирует изменения положения, структуру радикальных групп в активном центре фермента и активный центр под действием субстрата переходит в активное состояние и в свою очередь начинает воздействовать на субстрат т.е. происходит взаимодействие АЦ фермента и субстрата. В результате субстрат переходит в нестабильное неустойчивое состояние, в результате чего уменьшается энергия активации.
Взаимодействие фермента и субстрата различно это реакции нуклеофильного замещения, эелектрофильного замещения, дегидратация субстрата. Возможно ковалентное взаимодействие, а в основном происходит геометрическая переориентация функциональных групп активного центра. Второй показатель – ферменты увеличивающие стерический коэффициент.
Стерический коэффициент – вводится для реакции в которых участвуют крупные молекулы имеющие пространственную структуру. Стерический коэффициент – показывает долю удачных столкновений активных молекул.

Ферменты увеличивают стерический коэффициент так как они изменяют молекулы субстрата в фермент субстратном комплексе и комплиментарность возрастает.
2) До взаимодействия с ферментом молекулы располагаются хаотично, а после упорядочиваются.
Номенклатура ферментов.
Ферменты имеют несколько типов названий:
1) Тривиальные (трипсин, пепсин)
2) Рабочее номенклатура в этом названии присутсвует окончание –аза которое прибавляется:
· к названию субстрата (сахараза, амилаза),
· к виду связи на которую действует фермент (пептидаза, гликозидаза),
· к типу реакции, процесса (синтетаза, гидролаза).
У каждого фермента есть классификационное название в котором отражается тип реакции вид субстрата и кофермента например: ЛДГ – лактат-НАД+-окидоредуктаза.
Классификация ферментов.
1961 год согласно классификации расположен в определенном классе, подклассе, подподклассе и имеет порядковый номер. Поэтому каждый фермент имеет цифровой шифт первая цифра – класс, вторая – подкласс, третья – подподкласс, четвертая – порядковый номер (ЛДГ: 1,1,1,27). Все ферменты классифицируются на 6 классов.
- Оксидоредуктазы
- Трансферразы
- Гидролазы
- Лиазы
- Изомеразы
- Синтетазы (лигазы)
Оксидоредуктазы.
Ферменты катализирующие окислительно-востановительные процессы. Общий фид реакции: Аок + Ввос = Авост+Вок. Наиболее важный подкласс:
1.Дегидрогиназы, катализирует реакции путем отщепления водорода от окисляемого вещества они бывают аэробные (переносят водород на кислород) и анаэробные (переносят водород не на кислород, а на какое-то другое вещество).
2. Оксигеназы ферменты катализирующие окисление путем присоединение кислорода к окисляемому веществу. Если присоединяется один атом кислорода – монооксигеназы, если два – диоксигеназы.
3. Пероксидазы ферменты катализирующие окисление веществ при участии пероксидов.
Трансферразы.
Ферменты осуществляющие межмолекулярный перенос функциональных групп с одного вещества на другое АВ + С = А + ВС. Подклассы выделяют в зависимости от вида переносимых групп: аминотрансферразы, метилтрансферразы, сульфатрансферразы, ацилтрансферразы – переносят остатки жирных кислот, фосфотрансферразы – переносят остатки фосфорных кислот.
Гидролазы.
Катализирует разрыв химической связи с присоединением воды по месту разрыва то есть реакции гидролиза. АВ + НОН = АН + ВОН. Подклассы выделяют от вида разрываемых связей: пептидазы (пептин), гликозидазы - гликозидные связи (амилаза), эстеразы – сложноэфирные связи (липаза).
Лиазы.
Катализируют разрыв химической связи без присоединения воды по месту разрыва при этом в субстратах образуются двойные связи. АВ = А + В. Подклассы зависят от того между какими атомами разрывается связь и какие вещества образуются: альдолазы – разрывает связь медлу двумя атомами водорода например фруктоза 1,6-ди-фосфатальдолаза разрезает фруктозу и две триозы. К лиазам относят ферменты декарбоксилазы – они вырезают углекислый газ. Дегидротазы – вырезают молекулы воды.
Изомеразы.
Катализируют взаимопревращения различных изомеров. Фосфогексоизимераза переводит фруктозу в глюкозу, подклассы – мутазы (фосфоглюуомутаза переводит глюкозу 1 фосфат), эпимеразы переводят рибозу в ксилулозу, таутомеразы
Синтетазы (лигазы).
Это ферменты катализирующие реакции синтеза новых веществ за счет энергии АТФ, А+В+АТФ = АВ. Глютаминсинтетаза соединяется (глю+NH3+АТФ = глютамин).
Свойства ферментов.
Ферменты помимо общих с неорганическими катализаторами свойств имеют определенные отличия от неорганических катализаторов, к ним относится:
- более высокая активность
- более высокая специфичность
- более мягкие условия для катализа
- способность к регуляции активность
1. Высокая каталитическая активность. Примером является одна молекула карбоангидразы, которая за одну минуту катализирует (расщепляет) 36 миллионов молекул Н2СО3. Это высокая активность объясняется механизмами их действия так как они уменьшают энергию активации и увеличивает пространственный период (стерический коэффициент). Высокая активность ферментов имеет важное значение, состоящее в том что они обеспечивают высокую скорость химических реакций в нашем организме.
2. Высокая специфичность. Все ферменты обладают специфичностью, однако степень специфичности в разных ферментах различны, могут быть следующие виды:
Абсолютная – фермент действует только на одно определенное вещество например уреаза расщепляет только мочевину.
Абсолютная групповая – фермент вызывает один и тот же каталитический эффект у группы соединений. При групповой специфичности ферменты действуют на группу близких субстратов например алкогольдегидрогеназа окисляет не только С2Н5ОН, но и его гомологи (этиловый, бутиловый и другие спирты).
Относительная групповая –идет катализ разных классов органических веществ (трипсин проявляет пептидазную активность белка и эстеразную в сложных эфирах).
Стереохимическая – (оптическая специфичность) расщепляется только определенная форма изомеров (D, L формы, α, β, цис-, тарнс-). Наприер: ЛДГ действует только на L-лактат, L-амино-кислот-оксидазы действуют на L-изомеры.
Высокая специфичность объясняется уникальной структурой активного центра.
Термолябильность.
Это зависимость активности ферментов от температуры. При высокой температуре от 0 до 40 активность ферментов растет согласно правилу Вант-Гоффа: при возрастании температуры на 10 градусов скорость реакции возрастает в 2 – 4 раза. При дальгнейшем повышении температуры активность ферментов начинает снижаться, что объясняется тепловой денатурацией беловой молекулой фермента. Графически:
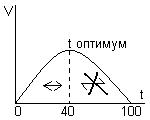
Инактивация фермента при 0 градусов обратима, а при высокой температуре инактивация необратима. Это свойство определяет максимальную скорость реакции, что в условиях температуры тела человека. Это свойство находит практическое применение например: при проведении ферментативной реакции в пробирке, необходимо создать максимальную температуру. Это может быть применено в криохирургии, когда сложная операция проводится при снижении температуры тела и это замедляет скорость реакции. Хранить ферментативные препараты надо при пониженной температуре. Для обезвреживания, обеззараживания микроорганизмов используют высокие температуры.
Фотолябильностью.
Зависимость активности от УФЛ. УФЛ вызывает фотоденатурацию белковых олекул и уменьшает активность ферментов и это используют для бактерицидного эффета.
Зависимость активности от рН.
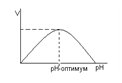 У всех ферментов есть определенный интервал рН в котором активность фермента максимальна - оптимум рН. Для многих ферментов оптимум около 7 у пепсина 1-2, для фермента щелочная фосфатаза около 9. При отклонении рН от оптимума активность фермента снижается это свойство объясняется изменением ионизации ионогенных групп в молекулах фермента, что ведет к изменению ионной связи в молекуле белка. Это ведет к изменению конформаци молекулы фермента, а это ведет к изменению активности. рН зависимость определяет максимальную активность ферментов в условиях организма. Это всойство находит и практическое применение. При сиженной кислотоности желудка назначают раствор НСl.
У всех ферментов есть определенный интервал рН в котором активность фермента максимальна - оптимум рН. Для многих ферментов оптимум около 7 у пепсина 1-2, для фермента щелочная фосфатаза около 9. При отклонении рН от оптимума активность фермента снижается это свойство объясняется изменением ионизации ионогенных групп в молекулах фермента, что ведет к изменению ионной связи в молекуле белка. Это ведет к изменению конформаци молекулы фермента, а это ведет к изменению активности. рН зависимость определяет максимальную активность ферментов в условиях организма. Это всойство находит и практическое применение. При сиженной кислотоности желудка назначают раствор НСl.
