Механизм действия ферментов
Фермент Е обратимо соединяется с субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р:

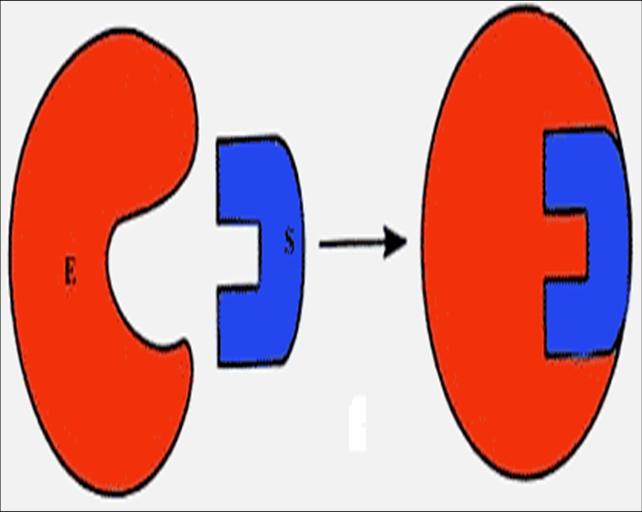
Подобные представления о взаимодействии фермента и субстрата легли в основу теории «ключ-замок» Э. Фишера(1890). Структура активного центра комплементарна молекулярной структуре субстрата, что обеспечивает высокую специфичность фермента (рис. 16а). В образовании фермент-субстратных комплексов участвуют электростатические и гидрофобные взаимодействия, водородные связи, а также ковалентные либо координационные связи.
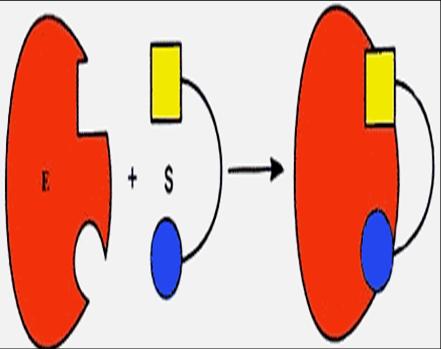 |
| а. Теория «перчатка – рука» |
 б. Теория «индуцированного соответствия» б. Теория «индуцированного соответствия» |
Рис. 16. Теории ферментативного катализа
Д. Кошлендом была разработана теория «индуцированного соответствия»(1958). Согласно данной теории, пространственное соответствие структуры активного центра фермента и субстрата возникает в момент их взаимодействия друг с другом. Это было образно охарактеризовано формулой «перчатка - рука». Субстрат индуцирует конформационные изменения активного центра фермента таким образом, что он принимает пространственную ориентацию, необходимую для связывания субстрата (рис. 16б). Т.е. фермент только в момент присоединения субстрата будет находиться в активной (напряженной) Т-форме (tensile) в отличие от неактивной R-формы (relaxe).
В настоящее время все более популярной становится гипотеза топохимического соответствия.Сохраняя основные положения теории «индуцированного соответствия», она объясняет специфичность действия ферментов узнаванием той части субстрата, которая не изменяется при катализе. В момент присоединения субстрата к активному центру фермента последний индуцирует переход субстрата в напряженное состояние (рис. 17).
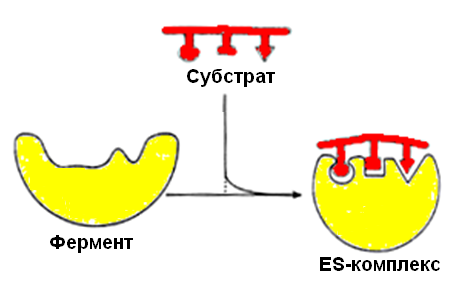
Рис. 17. Гипотеза топохимического соответствия
Ферменты ускоряют химические реакции за счет снижения энергии активации (рис. 18).
Энергия активации - энергия, необходимая для перевода всех молекул 1 моль вещества в активированное состояние при данной температуре.
Химическая реакция, как катализируемая ферментом, так и им не катализируемая, имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Однако энергия активации ферментативной реакции ниже. Увеличивая скорость реакции, ферменты, однавко, не изменяют положения равновесия между прямой и обратной реакциями, а лишь ускоряют его достижение.
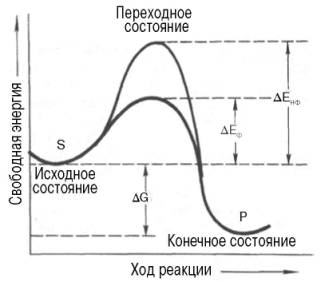
Рис. 18. Энергетическая диаграмма ферментативной реакции
