Задания для самостоятельной работы. 1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) серы; б) марганца.
Вариант №1
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) серы; б) марганца.
2. Составьте формулы оксидов и гидроксидов элементов второго периода, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений?
3. Дайте определение электроотрицательности. Как изменяется электроотрицательность р-элементов в VІІ-А подгруппе? Как изменяется их окислительная активность и почему?
4. Напишите электронные формулы атомов Zn и Cl и соответствующих ионов: Zn2+, Cl‾
Вариант №2
1.Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) железа; б) хлора.
2. Составьте формулы оксидов и гидроксидов элементов ІІІ-А подгруппы. Как изменяется кислотно-основной характер этих соединений и почему?
3. Дайте определение энергии ионизации. Как изменяется восстановительная активность элементов ІІ - А подгруппы и р-элементов ІІІ периода.
4. Напишите электронные формулы атомов Са и N и соответствующих ионов: Ca2+, N3‾.
Вариант №3
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) хрома; б) азота.
2. Какую низшую и высшую степень окисления проявляют углерод, фосфор, сера и йод? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Как изменяется их окислительная активность?
3. Что характеризует орбитальное квантовое число? Какие значения оно принимает? Какие типы электронных орбиталей вам известны?
4. Какое состояние атома называется возбужденным? Изобразите распределение электронов по квантовым ячейкам в нормальном и возбужденном состоянии атома фосфора.
Вариант №4
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) молибдена; б) углерода.
2. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Напишите формулы кислородных соединений этих элементов, укажите их характер.
3. Что называется сродством к электрону? Как изменяется окислительная активность неметаллов VІ-А подгруппы?
4. Напишите электронные формулы атомов Mn, Cl и соответствующих ионов: Mn4+, S2‾.
Вариант №5
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) никеля; б) мышьяка.
2. Составьте формулы оксидов и гидроксидов элементов третьего периода, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений?
3. Как изменяется электроотрицательность и окислительная активность элементов ІV-А подгруппы? Составьте формулы водородных соединений элементов этой группы.
4. Напишите электронные формулы атомов Fe и Se и соответствующих ионов: Fe6+, Se2‾.
Вариант №6
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) цинка; б) кремния.
2. У какого из элементов четвертого периода – хрома или селена – сильнее выражены металлические свойства? Почему? Составьте формулы оксидов и гидроксидов, укажите их характер.
3. Как изменяется восстановительная активность элементов третьего периода? Почему? Составьте формулы оксидов этих элементов.
4. Напишите электронные формулы атомов Co и Cl и соответствующих ионов: Co2+, Cl3+.
Вариант №7
1.Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) алюминия; б) германия.
2. Марганец образует соединения, в которых проявляет степени окисления: 2+, 3+, 4+, 6+, 7+. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления, укажите их характер.
3. Как изменяется окислительная активность элементов ІV-А подгруппы, р-элементов V периода? Дайте мотивированный ответ.
4. Напишите электронные формулы ионов: P5+, Cr3+.
Вариант №8
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) ванадия; б) йода.
2. Исходя из величины степени окисления атомов, определите, какой из двух гидроксидов является более сильным основанием: а) Fe(OH)2 или Fe(OH)3,
б) Mn(OH)2 или Mn(OH)4, в) Sn(OH)2 или Sn(OH)4?
3. Как изменяется радиус атомов у элементов V-А подгруппы, р-элементов четвертого периода? Как изменяется их окислительная активность?
4. Напишите электронные формулы ионов: Br5+, Co2+.
Вариант №9
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) сурьмы; б) меди.
2. Какую высшую и низшую степени окисления проявляет кремний, мышьяк, селен, хлор? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
3. Как изменяется восстановительная активность s–элементов первой группы? Составьте формулы оксидов и гидроксидов элементов этой группы. Как изменяется основной характер этих гидроксидов?
4. Напишите электронные формулы атомов и соответствующих ионов: Mn7+, I‾.
Вариант №10
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) молибдена; б) брома.
2. У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Составьте формулы водородных и кислородных соединений этих элементов.
3. Как изменяется восстановительная активность металлов II-А подгруппы? Как изменяется основной характер оксидов и гидроксидов этих металлов?
4. Напишите электронные формулы атомов Ni, P и соответствующих ионов: Ni3+, P3‾.
Вариант №11
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) железа; б) селена.
2. Какую низшую степень окисления проявляют: хлор, сера, азот, углерод? Составьте формулы водородных соединений этих элементов. Как изменяется восстановительная способность этих соединений?
3. Укажите самый активный металл и неметалл пятого периода. Напишите формулы их оксидов и укажите их характер.
4. Напишите электронные формулы атомов Br, Mn и соответствующих ионов: Br‾, Mn6+.
Вариант №12
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) вольфрама; б) фосфора.
2. Как изменяются свойства р–элементов V-А подгруппы? Составьте формулы соединений, отвечающих их низшей и высшей степеням окисления.
3. Хлор образует соединения, в которых он проявляет степени окисления 1+, 3+, 5+, 7+. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Как изменяется сила кислот?
4. Напишите электронные формулы атомов Al, As и соответствующих ионов: Al3+, As3‾.
Вариант №13
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) марганца; б) германия.
2. Как изменяется кислотно-основной характер оксидов и гидроксидов хрома, соответствующих степеням окисления 2+, 3+, 6+?
3. Как изменяется окислительная активность, неметаллические свойства элементов VІІ-А подгруппы? Составьте формулы водородных соединений элементов этой подгруппы.
4. Напишите электронные формулы атомов Ca, Sn и соответствующих ионов: Ca2+, Sn4+.
Вариант №14
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) бария; б) брома.
2. На каком основании хром и сера, фосфор и ванадий располагаются в одной группе? Почему их помещают в разные подгруппы? Составьте формулы высших оксидов этих элементов и определите их характер.
3. Какое состояние атома называется возбужденным? Изобразите распределение электронов по квантовым ячейкам в нормальном и возбужденном состояниях атома серы.
4. Напишите электронные формулы ионов: Ge4‾, Pb2+.
Вариант №15
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) олова; б) фосфора.
2. Что характеризует спиновое квантовое число электрона? Какова максимальная спин-валентность атома с распределением валентных электронов …5s25p3?
3. Как изменяется электроотрицательность, окислительная активность, неметаллические свойства р-элементов пятого периода? Составьте формулы высших оксидов этих элементов.
4. Напишите электронные формулы ионов: Cr3+, Cl‾.
4. ТЕМА: "Химическая связь, строение молекул"
Теория химической связи относится к числу основных вопросов курса химии, т. к. свойства веществ и их реакционная способность зависят не только от состава, строения молекул, но и от типа химической связи между атомами. При изучении этой темы необходимо:
- разобраться в механизме образования ионной, ковалентной и металлической связей;
- усвоить свойства и разновидности ковалентной связи;
- изучить особенности свойств соединений с различными типами химических связей;
- приобрести навыки в составлении электронных схем образования молекул с различными типами химической связи.
1. Укажите тип химической связи в молекулах соединений вашего варианта.
2. Составьте электронные схемы образования молекул с ковалентной связью. Электроны, каких орбиталей атомов принимают участие в образовании ковалентной связи? Определите валентность и степени окисления атомов в молекуле.
3. Изобразите электронными уравнениями процессы образования соединений с ионной связью.
Варианты контрольных заданий в таблице №2
| №варианта | Формулы соединений | ||||
| I2 | HI | CrCl3 | PbO | (H2O)n | |
| NH4Cl | BaI2 | AsH3 | K2O | F2 | |
| Cl2 | Mn2O3 | CH4 | ZnS | SiO2 | |
| Fe2O3 | N2 | NaBr | NH4+ | SO2 | |
| Al | MgO | N2 | H2S | FeCl3 | |
| PCl3 | HF | Mn2O3 | Cl2 | PI2 | |
| CO2 | H2S | PbCl4 | Fe2S3 | Br2 | |
| KOH | Br2 | ZnO | AlBr3 | H2O | |
| CuCl | HBr | CO2 | Cr2O3 | I2 | |
| O2 | CaS | Na2O | H2S | CCl4 | |
| (HF)n | SiBr4 | Cl2 | CuO | AlI3 | |
| Cu | F2 | Al2O3 | KBr | SiO2 | |
| Br2 | CH4 | NaOH | Cu2O | Al2S3 | |
| NH3 | SiO2 | MgBr2 | CrO | I2 | |
| HBr | Fe2O3 | (H2O)n | Cl2 | FeCl3 |
5. ТЕМА: "Комплексные соединения"
При изучении этой темы необходимо:
- разобраться в механизме донорно-акцепторной связи и особенностях координационных соединений, их структуре, устойчивости и типах лиганд;
- уметь определять координационное число иона-комплексообразователя, его заряд, а также заряд комплексного иона; дать названия рассматриваемым комплексным соединениям.
- приобрести навыки в составлении уравнений реакций образования и диссоциации комплексных соединений;
- иметь представление о значении и применении минеральных, органических и органоминеральных комплексных соединений в сельском хозяйстве.
1. Заполните пропуски в таблице №3 и напишите выражения для констант диссоциации (нестойкости) комплексных ионов.
| № | Комлексообразователь | Лиганды | Координационное число | Внутренняя сфера комплекса | Ионы внешней сферы | Формула комплексного соединения |
| К2[Zn(OH)4] | ||||||
| Pt4+ | Cl─ | K+ | ||||
| [Cu(NH3)4]2+ | SO42─ | |||||
| Al3+ | OH─ | Na+ | ||||
| Cr3+ | H2O | Cl─ | ||||
| K[BF4] | ||||||
| [Zn(OH)4]2─ | Na+ | |||||
| Fe3+ | CN─ | K+ | ||||
| Au3+ | Cl─ | H+ | ||||
| K[Ag(CN)2] | ||||||
| [Co(NH3)6]3+ | Cl─ | |||||
| Ni2+ | H2O | SO42─ | ||||
| K2[Ni(CN)4] | ||||||
| Ag+ | NH3 | Cl─ | ||||
| [Al(OH)4]─ | K+ | |||||
| Na3[Co(NO2)6] | ||||||
| Pt2+ | NH3 | Cl─ | ||||
| [Ni(NH3)6]SO4 | ||||||
| [FeF6]4─ | K+ | |||||
| Na3[CoF6] | ||||||
| Al3+ | H2O | Cl─ | ||||
| K3[AlF6] | ||||||
| Sn2+ | OH─ | Na+ | ||||
| [Cu(H2O)4]2+ | NO3─ | |||||
| Na3[CoF6] | ||||||
| W4+ | CN─ | K+ | ||||
| Cu2+ | CN─ | Na+ | ||||
| [Ni(NH3)6]2+ | Br─ | |||||
| Na2[HgI4] | ||||||
| Ca2+ | NH3 | Cl─ |
2.Определите заряд внутренней координационной сферы и составьте формулы двух веществ, в которые она входит. Определите координационное число комплексообразователя:
1. [Co3+(NH3)6]; 9. [Co3+(NH3)2(NO2)4];
2. [Ni3+(H2O)4Cl2]; 10. [Pt4+Cl6];
3. [Zn2+ (OH) 4]; 11. [Fe2+ (CN) 6];
4. [Sb5+ (OH) 6]; 12. [Co3+F6];
5. [Co3+ (NH3)5Br]; 13. [Pt4+Br4];
6. [Fe3+F6]; 14. [Au3+Cl4];
7. [Co3+ (NH3)5SO4]; 15. [Co3+(NO2)6];
8. [Pt4+(NH3)4Cl];
3. Составьте молекулярные и ионные уравнения реакций, приводящие к образованию одного малорастворимого вещества:
1. FeCl3+K4 [Fe (CN) 6] →
2. [Pt (NH3)6] Cl4+AgNO3 →
3. K2SO4+Na3 [Co (NO2)6] →
4. [Pt (NH3)3Cl3] Cl+Pb (NO3)2 →
5. FeSO4+K3 [Fe (CN) 6] →
6. NaCl+K [Sb (OH) 6] →
7. [Co (NH3)5SO4] Cl+AgNO3 →
8. [Cu (NH3)4] SO4+BaCl2 →
9. [Co (NH3)5SO4] Br+AgNO3 →
10. [Co (NH3)5Br] SO4+BaCl2 →
11. CuSO4+K4 [Fe (CN) 6] →
12. Na3 [Co (CN) 6] +FeSO4 →
13. K3 [Fe (CN) 6] +AgNO3 →
14. K [Sb (OH) 6] +Na2SO4 →
15. Na3 [Co (CN) 6] +KCl →
4. Представьте указанные в вашем варианте вещества в виде комплексных соединений:
1. KCN∙AgCN; 9. 2KCN∙Ni(CN)2;
2. Co (NO3)3∙6NH3; 10. 2KCl∙PtCl4;
3. 2KCN∙Cu (CN) 2; 11. AgCl∙2NH3;
4. CoCl3∙6NH3; 12. 4KCN∙W (CN) 4;
5. 2KSCN∙Co (SCN) 2; 13. 2NH3∙PtCl4;
6. 4KCN∙Fe (CN) 2; 14. CoF3∙3NaF;
7. KCl∙AuCl3; 15. CrCl3∙6H2O;
8. CuCl2∙4NH3;
6. ТЕМА "Энергетика химических процессов"
Вопросы энергетики химических процессов являются предметом изучения отдельного раздела химии, называемого химической термодинамикой. Основными задачами этого раздела являются определение тепловых эффектов химических реакций, возможности самопроизвольного их течения в заданных условиях, а также выявление наиболее рациональных условий, обеспечивающих эффективный ход процесса.
При изучении данной темы студент должен:
- ознакомиться с основными термодинамическими понятиями и величинами;
- понять сущность и практическую значимость первого закона термодинамики, закона Гесса, второго закона термодинамики;
- разобраться в практических расчетах изобарного теплового эффекта при стандартных условиях ∆Н0298, изменения энтропии ∆S0298 и энергии Гиббса ∆G0298 для любой химической реакции;
- научиться на основе расчетов ∆Н, ∆S, ∆G судить о выделении или поглощении теплоты в процессе реакции, а также возможности ее самопроизвольного протекания.
Задание для самостоятельной расчетной работы
1. Используя справочные данные таблицы №5 , определите изобарный тепловой эффект ∆Н0298 химической реакции вашего варианта (таблица №4). Сделайте вывод о выделении или поглощении теплоты в процессе реакции.
2. Определите изменение энтропии ∆S0298 в ходе химической реакции, протекающей при стандартных условиях в идеальном газообразном состоянии. Объясните знак изменения ∆S0298 в результате данной реакции.
3. Определите изменение энергии Гиббса ∆G0298 в ходе химической реакции, используя справочные данные таблицы № 5. По знаку изменения энергии Гиббса ∆G0298 сделайте вывод о возможности самопроизвольного протекания.
Таблица №4
| № Варианта | Химические реакции |
| 1. | 4NH3(г)+5О2(г)↔6Н2О(г)+4NO(г) |
| 2. | CO(г)+3H2(г) ↔CH4(г)+H2O(г) |
| 3. | 4HCl(г)+О2(г) ↔2H2O(г)+Cl2(г) |
| 4. | 2CO(г)+3H2(г) ↔CH4(г)+CO2(г) |
| 5. | 2CH4(г)+О2(г) ↔2СO(г)+4H2(г) |
| 6. | CH4(г)+2H2O(г) ↔CO2(г)+4H2(г) |
| 7. | CH4(г)+H2O(г) ↔CO(г)+3H2(г) |
| 8. | 4NH3(г)+3О2(г) ↔6Н2О(г)+2N2(г) |
| 9. | C2H4(г)+3О2(г) ↔2СO2(г)+2H2O(ж) |
| 10. | 4NH3(г)+5О2(г) ↔6Н2О(ж)+4NO(г) |
| 11. | CH4(г)+О2(г) ↔2СO(г)+2H2O(г) |
| 12. | CO(г)+H2O(ж) ↔CO(г)+H2(г) |
| 13. | CH4(г)+СО2(г) ↔2СO(г)+2H2(г) |
| 14. | CH4(г) ↔C2H2(г)+3H2(г) |
| 15. | 2CO(г)+3H2(г) ↔C2H2(г)+3H2O(ж) |
Таблица №5
| Вещество | Состояние | ∆Н0298, 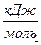 | ∆G0298, 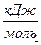 | S0298,  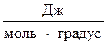 |
| С2Н2 | г | 226,750 | 209,200 | 200,820 |
| NO | г | 90,370 | 86,690 | 210,200 |
| С2Н4 | г | 52,280 | 68,173 | 219,450 |
| NH3 | г | -45,190 | -16,647 | 192,500 |
| CH4 | г | -74,850 | -50,830 | 186,190 |
| СО | г | -110,520 | -137,270 | 197,910 |
| СО2 | г | -393,510 | -394,380 | 213,650 |
| H2O | г | -241,830 | -228,590 | 188,720 |
| H2O | ж | -285,950 | -237,190 | 69,940 |
| N2 | г | 0,000 | 0,000 | 200,000 |
| H2 | г | 0,000 | 0,000 | 130,590 |
| О2 | г | 0,000 | 0,000 | 205,030 |
| Cl2 | г | 0,000 | 0,000 | 222,950 |
7. ТЕМА "Кинетика химических реакций. Химическое равновесие"
Учение о кинетике химических процессов является одним из важных разделов химии, посвященных изучению скоростей химических реакций в зависимости от различных факторов (концентрации реагентов, температуры, давления, катализаторов и др.). При рассмотрении обратимых химических реакций с одинаковыми скоростями прямого и обратного процессов (состояние химического равновесия), большое значение имеет принцип смещения химического равновесия Ле Шателье.
При изучении данного раздела необходимо:
- выучить закон действующих масс, правило Вант-Гоффа, принцип Ле Шателье;
- уметь составлять выражения скоростей прямой и обратной реакции для любого химического процесса;
- знать, как влияют различные факторы: температура, давление, концентрация, наличие катализатора на скорость химических реакций и особенности действия катализаторов;
- уметь составлять выражение константы химического равновесия, грамотно использовать принцип Ле Шателье при определении смещения химического равновесия.
Пример: N2 + 3H2  2NH3 + Q
2NH3 + Q
Скорость прямой реакции: 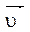 =
= 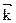
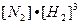 ;
;
Скорость обратной реакции: 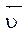 =
= 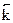
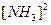 ;
;
Константа равновесия: Кс = 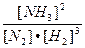
При увеличении концентрации Н2 равновесие сместится вправо, т.к. по правилу Ле Шателье преимущество получит та реакция, в ходе которой водород будет расходоваться, т.е. прямая.
При увеличении температуры равновесие сместится влево т.к. по правилу Ле Шателье преимущество получит та реакция, в ходе которой температура системы понижается, т.е. обратная реакции, идущая с поглощением теплоты.
При увеличении давления равновесие сместится вправо т.к. по правилу Ле Шателье преимущество получит та реакция, в ходе которой давление в системе понижается, т.е. прямая реакции, в ходе которой из 4 моль вещества образуется 2 моль вещества.
