Определение активности α-амилазы слюны по Вольгемуту.
Метод основан на установлении предельного разведения раствора α-амилазы, при котором еще происходит в определенных условиях расщепление заданного количества крахмала до эритродекстрина. Методом Вольгемута можно пользоваться для определения
α-амилазы в панкреатическом соке, крови, моче и других биологических жидкостях. Но данный метод дает лишь приблизительные результаты.
Собирают слюну. 1 мл слюны помещают в пробирку, добавляют 9 мл дистиллированной воды и перемешивают. Получается раствор слюны 1:10.
В 10 пронумерованных пробирок наливают по 1 мл воды. В первую пробирку вносят
1 мл раствора слюны и перемешивают путем трехкратного втягивания и выпускания жидкости из пипетки. Затем 1 мл жидкости из первой пробирки переносят во вторую пробирку, перемешивая содержимое, как указано выше. 1 мл жидкости из второй пробирки переносят в третью и т. д. Из десятой пробирки после перемешивания 1 мл жидкости удаляют.
Во все пробирки, начиная с десятой, добавляют по 2 мл 0,1 % раствора крахмала, содержимое перемешивают. Пробирки помещают в термостат при 37 °С на 30 минут.
Через 30 минут пробирки охлаждают под краном и добавляют в каждую по 1 капле раствора Люголя. Полученные данные заносят в таблицу. Отмечают пробирку с наибольшим разведением слюны, при котором произошло расщепление крахмала до эритродекстрина, дающего с йодом красно-бурое окрашивание.
Активность α-амилазы выражают количеством миллилитров 0,1 % раствора крахмала, которое может расщепить 1 мл неразведенной слюны при 37 °С в течение 30 минут до стадии эритродекстрина.
Пример: если красно-бурая окраска отмечена в четвертой пробирке, где слюна разбавлена в 160 раз. 1 мл неразбавленной слюны расщепил бы в 160 раз больше раствора крахмала за 30 минут при 37 °С: 2 мл×160 = 320 мл 0,1 % раствора крахмала. Условно это принимают за 320 единиц α-амилазы по Вольгемуту: А37°/30' = 320 ед.
Наблюдения:
| № п/п | Разведение слюны | Окраска в реакции с йодом |
Расчеты:
Контрольные вопросы
1. Какова роль ферментов в организме?
2. К какому классу химических соединений можно отнести ферменты?
3. Что представляет собой активный центр фермента?
4. Каковы особенности действия ферментов по сравнению с действием неорганических катализаторов?
5. Почему при кипячении растворов ферментов происходит их инактивация?
7. Какое влияние оказывает изменение рН среды на активность ферментов и почему?
8. Какой принцип лежит в основе качественного определения ферментов?
9. Что такое активаторы и ингибиторы ферментов? Как можно исследовать их влияние на действие фермента?
10. Приведите примеры использования ферментов в медицине.
Задания по теме «Биохимия белков и ферментов»
1. Напишите пептид: Сер – Глу – Про – Лиз – Гис.
а) Подберите свойство радикала для каждой из аминокислот пептида:
1. Гидрофильный с анионной группой
2. Гидрофильный скатионной группой
3. Гидрофильный незаряженный
4. Гидрофобный
б) Какие аминокислоты пептида соответствуют следующим характеристикам:
1. С-концевая аминокислота
2. Иминокислота
3. Диаминомонокарбоновая кислота?
в) Какой суммарный заряд имеет данный пептид? В какой среде лежит ИЭТ данного пептида?
2. Напишите пептид: Глу – Apг – Тир – Асп – Мет.
а) Подберите свойство радикала для каждой из аминокислот пептида:
1. Гидрофильный с анионной группой
2. Гидрофильный скатионной группой
3. Гидрофильный незаряженный
4. Гидрофобный
б) Какие аминокислоты пептида соответствуют следующим характеристикам:
1. N концевая аминокислота
2. Аминокислота, содержащая гуанидиновую группу
3. Моноаминодикарбоновая аминокислота?
в) Какой суммарный заряд имеет данный пептид при рН=7? Что такое изоэлектрическая точка белка, и какова ИЭТ данного пептида (>7, =7 или <7)?
3. Напишите пептид: Вал – Цис – Apг – Асп – Глн.
a) Подберите свойство радикала для каждой из аминокислот пептида:
1. Гидрофильный с анионной группой
2. Гидрофильный с катионной группой
3. Гидрофильный незаряженный
4. Гидрофобный.
б) Какие аминокислоты пептида соответствуют следующим характеристикам:
1. Аминокислота, содержащая амидную группу
2. Аминокислота, содержащая гуанидиновую группу
3. Моноаминодикарбоновая аминокислота
в) Какой суммарный заряд имеет данный пептид? В какой среде лежит ИЭТ данного пептида?
4. Напишите пептид: Три – Лей – Глу – Тре – Aрг.
а) Подберите свойство радикала для каждой из аминокислот пептида:
1. Гидрофильный с анионной группой
2. Гидрофильный с катионной группой
3. Гидрофильный незаряженный
4. Гидрофобный.
б) Какие аминокислоты пептида соответствуют следующим характеристикам:
1. Аминокислота, содержащая гидроксильную группу
2. Аминокислота, содержащая амидную группу
3. Гетероциклическая аминокислота?
в) Какой суммарный заряд имеет данный пептид? В какой среде лежит ИЭТ данного пептида?
5. Напишите пептид: Тре – Лиз – Глу – Тир – Aрг - Цис.
а) Подберите свойство радикала для каждой из аминокислот пептида:
1. Гидрофильный с анионной группой
2. Гидрофильный с катионной группой
3. Гидрофильный незаряженный
4. Гидрофобный
5. Ароматический.
б) Какие аминокислоты пептида соответствуют следующим характеристикам:
1. Аминокислота, содержащая гидроксильную группу
2. Аминокислота, содержащая амидную группу
3. Серусодержащая аминокислота?
в) Какой суммарный заряд имеет данный пептид? В какой среде лежит ИЭТ данного пептида?
6.В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, радикалы которых могут образовать связи и укажите тип связи.
1. Сер, Асн 2. Ала, Вал 3. Глу, Асп 4. Гис, Асп 5. Цис, Ала 6. Сер, Глн
7. В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, радикалы которых могут образовать связи и укажите тип связи.
1. Асп, Лиз 2. Вал, Тре 3. Apг, Гис 4. Глу, Сер 5. Три, Иле 6.Тре, Глн
8. В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, радикалы которых могут образовать связи и укажите тип связи.
1. Асп, Три 2. Асн, Тре 3. Apг, Лиз 4. Глу, Гис 5. Мет, Иле 6. Цис, Глн
9. В полипептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, радикалы которых могут образовать связи и укажите тип связи.
1. Асп, Мет 2. Вал, Иле 3. Сер, Гис 4. Глу, Apг 5. Три, Тре 6. Цис, Глн
10. Напишите структурную формулу пентапептида следующего строения:
Цис - Арг - Фен - Глу - Три
а) Обозначьте N- и С-концы пептида.
б) Отметьте регулярно повторяющиеся группы, образующие пептидный остов, и радикалы аминокислот.
в) Какие из изученных Вами цветных реакций будут положительны с данным пептидом?
11. Установите соответствие
А. Вал-Гли-Сер-Мет 1. Пептид, связывающий ноны Са+2 при рН=7
Б Гис-Тpe-Лиз-Глн 2. Пептид, имеющий ИЭТ при рH>7
В. Глу-Три-Фен-Aрг 3. Пептид, имеющий на С-конце иминокислоту
Г. Цис-Глу-Фен-Асп
Д. Асп-Тир-Иле-Про
12. Установите соответствие
А. Сер-Мет-Глн-Арг 1. Пептид, содержащий все циклические аминокислоты
Б. Асн-Сер-Тре-Глн 2. Пептид, имеющий серусодержащую аминокислоту
В. Гли-Глу-Tpe-Aсп 3. Пептид, содержащий все гидрофобные аминокислоты
Г. Фен-Три-Про-Тир
Д. Ала-Иле-Вал-Про
В какой области будут находиться изоэлектрические точки этих пептидов?
13. Установите соответствие:
A. Сер-Гис-Лиз-Мет 1. Нерастворимый в воде пептид
Б. Ала-Про-Три-Фен 2. Пептид, имеющий при pН=7 положительный заряд
B. Тре-Цис-Арг-Асн 3. Пептид, ИЭТ которого лежит в кислой среде
Г. Acн-Гис-Tир-Лиз
Д. Тре-Глу-Сер-Асп
14. Попробуйте предсказать, в какой конформации скорее всего окажутся приведенные ниже пептидные фрагменты в белке: в a-спирали или в составе b-структуры:
а) поли-L-лейцин;
б) поли-L-валин;
в) Pro-Glu-Met-Val-Phe-Asp-Ile;
г) Pro-Glu-Ala-Leu-Phe-Ala-Ala.
15. Попробуйте предсказать, в какой конформации скорее всего окажутся приведенные ниже пептидные фрагменты в белке - в a-спирали или в составе b-структуры:
а) поли-L-ала;
б) поли-L-фенала;
в) Ala-Glu-Met-Val-Phe-Met-Gln;
г) Pro-Val-Asp-Leu-Gly-Asn-Ala.
16. Попробуйте предсказать, в какой конформации скорее всего окажутся приведенные ниже пептидные фрагменты в белке - в a-спирали или в составе b-структуры:
а) поли-L-тир;
б) поли-L-гис;
в) лиз-мет-иле-ала-глн-ала;
г) фен-ала-вал-тре-тир-вал.
17. Какие из пептидов, приведенных ниже, будут давать положительную реакцию Фоля (сульфгидрильную реакцию)? Ответ обоснуйте. Приведите уравнение реакции Фоля, написав его с необходимой аминокислотой.
а) NH2–Ala–Cys–Phe–Cys–СООН; б) NH2–Gly–Val–Gly–Ser–Ala–СООН;
в) NH2–Ser–Ala–Met–Pro–СООН; г) NH2–Gly–Cys–Cys–Ala–Ala–СООН.
18. Глобулярные белки характеризуются определенным расположением специфических аминокислот. По данным рентгеноструктурного анализа миоглобина и других одноцепочечных глобулярных белков небольших размеров был сделан ряд обобщений, касающихся укладки полипептидных цепей растворимых белков. Исходя из этих обобщений, укажите наиболее вероятное расположение (внутри или на поверхности молекулы нативного глобулярного белка) аминокислотных остатков аспарагиновой кислоты, лейцина, серина, валина, глутамина и лизина. Поясните свой ответ.
19. Глобулярные белки характеризуются определенным расположением специфических аминокислот. По данным рентгеноструктурного анализа миоглобина и других одноцепочечных глобулярных белков небольших размеров был сделан ряд обобщений, касающихся укладки полипептидных цепей растворимых белков. Исходя из этих обобщений, укажите наиболее вероятное расположение (внутри или на поверхности молекулы нативного глобулярного белка) аминокислотных остатков аргинина, валина, аланина, глутаминовой кислоты, серина. Поясните свой ответ.
20. Какие из перечисленных ниже пептидов будут давать положительную ксантопротеиновую реакцию (стрелки в формуле грамицидина S направлены к аминокислотам, аминогруппы которых участвуют в построении пептидных связей)? Ответ обоснуйте. Напишите уравнение ксантопротеиновой реакции с необходимой аминокислотой. Какой биологической активностью обладает грамицидин S и глутатион?
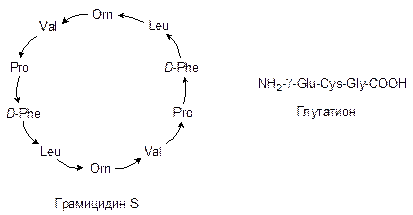
21. Пентапептид, образующийся при обработке белка трипсином, содержит аргинин, аспарагиновую кислоту, лейцин, серин и тирозин. Для определения аминокислотной последовательности провели три последовательных расщепления по Эдману.
Полученные после каждого расщепления пептиды имели следующий состав:
первое расщепление - аргинин, аспарагиновая кислота, лейцин, серин;
второе расщепление - аргинин, аспарагиновая кислота, серин;
третье расщепление - аргинин, серин.
Какова последовательность пентапептида?
22. В гидролизате пептида найдены ала, вал, глу, фен, тир, гли, лиз, лей, мет и NH3. При обработке пептида по методу Сэнджера выявлен ДНФ-аланин, карбоксипептидазой - глицин. В триптическом гидролизате обнаружено два пептида: первый состоит из вал, ала, глн, лиз, фен; второй - из мет, гли, лей, тир и при обработке по Сэнджеру дает ДНФ-лейцин. В химотриптическом гидролизате найдено три пептида: первый содержит мет, гли; второй - вал, ала, фен, глн; третий - лей, тир, лиз. Выведите на основании всей совокупности данных первичную структуру исходного пептида.
23. Тетрапептид содержит аланин, лизин, пролин и валин. В результате реакции тетрапептида с динитрофторбензолом и последующего гидролиза ДНФ-пептида раствором соляной кислоты (6 моль/л) был получен ДНФ-аланин. Гидролиз тетрапептида трипсином дает два соединения, одно из которых окрашивается нингидрином в сине-фиолетовый, а другое - в желтый цвет. Какова первичная структура тетрапептида?
24. Определите последовательность аминокислот в тетрапептиде, используя следующие данные:
а) При анализе N-концевой аминокислоты и аминокислотного состава пептида получено: Асп-(Про, Тир, Мет);
б) После гидролиза бромистым цианом, который расщепляет связи с участием карбоксильной группы метионина, образуется трипептид, содержащий Тир, Мет, Асп.
25. Напишите структурную формулу следующего пептида:
(H2N)гли-гли-про-три-мет-глу-ала-тир-гли-три-мет-асп-фен(ОН).
Укажите, какие соединения получатся при действии на него бромциана, учитывая, что последний расщепляет пептидную связь, образованную метионином, превращая метионин в гомосеринлактон:

26. Определите изоэлектрическую точку соединений, приведенных в таблице, при
25 °С, зная, что pKa при указанной температуре соответственно равны:
| Соединение | pKa1 | Pka2 |
| Глицин | 2,4 | 9,7 |
| Изолейцин | 2,36 | 9,68 |
| Саркозин | 2,23 | 10,01 |
| Глицилглицин | 3,06 | 8,13 |
27. Определите изоэлектрическую точку соединений, приведенных в таблице, при
25 °С, зная, что pKa при указанной температуре соответственно равны:
| Соединение | pKa1 | Pka2 |
| α-Аланин | 2,34 | 9,69 |
| β-Аланин | 3,60 | 10,19 |
| Изолейцин | 2,36 | 9,68 |
| Глицилаланин | 3,15 | 8,25 |
28. Рассчитайте значения изоэлектрических точек глицина, аспарагиновой кислоты и лизина. Значения pKa для указанных аминокислот следующие:
| Соединение | pKa1 | pKa2 | pKa3 |
| Глицин | 2,4 | 9,7 | - |
| Аспарагиновая кислота | 1,9 | 3,7 | 9,6 |
| Лизин | 2,2 | 8,9 | 10,5 |
В каких позициях от линии старта окажутся перечисленные аминокислоты после их электрофоретического фракционирования в буферной системе с pH=6,5?
29. Дана смесь белков:
| Название белка | Молекулярная масса | рI белка |
| Церулоплазмин | 151 000 | 4,4 |
| g- Глобулин | 150 000 | 6,3 |
| b- Лактоглобулин | 37 100 | 5,2 |
Предложите методы разделения белков и укажите последовательность их выделения из смеси.
30. Большинство глобулярных белков при кратковременном нагревании до 65 °С денатурирует с полной потерей активности. Однако те глобулярные белки, в которых содержится много остатков цистина, денатурируют только при более длительном нагревании до более высоких температур. Одним из таких белков является рибонуклеаза, содержащая
124 аминокислотных остатка в единственной полипептидной цепи, в которой имеется четыре поперечные дисульфидные связи, образованные остатками цистина. Чтобы полипептидная цепь рибонуклеазы развернулась, необходимо нагреть содержащий ее раствор до высокой температуры. Если затем быстро охладить его, то ферментативная активность восстанавливается. Можете ли Вы указать молекулярную основу такого поведения?
31. При каких значениях рН наиболее целесообразно электрофоретическое фракционирование нижеперечисленных белковых смесей: а) миозина и гемоглобина; б) уреазы и гемоглобина; в) щелочной фосфатазы, сывороточного альбумина и уреазы; г) цитохрома с и гемоглобина, если изоэлектрическая точка миозина - 5,4; щелочной фосфатазы - 4,5; гемоглобина - 6,8; уреазы - 5,0; цитохрома с -10,65; сывороточного альбумина – 4,6.
32. Используя обозначения: К - катод, А - анод, С - линия старта, укажите направление перемещения при электрофорезе следующих белков: а) тропомиозин - в буферной системе с рН=5,1; б) гемоглобин - рН=4,8; в) рибонуклеаза - рН=4,2; 9,5 и 11,3, учитывая, что изоэлектрическая точка тропомиозина - 5,1, гемоглобина - 6,8, рибонуклеазы - 9,45.
33. Смесь аминокислот, содержащая валин, лейцин, аспарагиновую кислоту, лизин, гистидин и серин, была подвергнута фракционированию методом электрофореза на бумаге при pH=6,2. Какие из указанных аминокислот будут перемещаться к катоду, к аноду или останутся на линии старта?
34. Проводят электрофорез аминокислот на бумаге: каплю раствора, содержащего смесь глицина, глутаминовой кислоты, лизина, аргинина и гистидина, нанесли на середину полоски бумаги и дали ей высохнуть. Затем бумагу смочили буфером с рН 6,0 и к концам полоски приложили электрическое напряжение.
а) Какая аминокислота (ы) будет двигаться к аноду?
б) Какая аминокислота (ы) будет двигаться к катоду?
в) Какая аминокислота (ы) останется на стартовой точке или вблизи нее?
35. Изобразите полные структуры следующих пептидов (ионизуемые группы изобразите в протонированном состоянии):
а) метионилглутамин,
б) глутамиласпартилфенилаланин,
в) Фeн-Арг-Трп-Иле.
Возможно ли разделение этих пептидов методом электрофореза? Ответ поясните.
36. Смесь глицина, аланина, глутаминовой кислоты, лизина, аргинина и серина разделяли методом электрофореза на бумаге при рН 6,0. Укажите, какие соединения двигались к аноду - А (а), к катоду - К (б), оставались на старте - С (в).
37. Олигомерный белок массой 660 мг обрабатывали избытком
2,4-динитрофторбензола в слабощелочной среде до завершения химической реакции. Затем пептидные связи белка были подвергнуты полному гидролизу путем нагревания белка в присутствии концентрированной HCl. В гидролизате содержалось 5,5 мг следующего соединения:
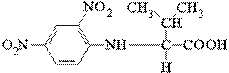 .
.
Никаких других 2,4-динитрофенильных производных, образующихся в реакции с
α-аминогруппами аминокислот, обнаружено не было.
а) Объясните, почему эти данные можно использовать для определения числа полипептидных цепей в олигомерном белке.
б) Рассчитайте число полипептидных цепей в этом белке (молекулярная масса 132000).
38. Опишите строение активного центра гемоглобина и роль гистидина в его функционировании. Каким образом строение активного центра облегчает взаимодействие гема с О2 и затрудняет его контакт с водой? Приведите пример гемоглобинопaтии, вызванной нарушением строения активного центра Нb.
39.Соли тяжелых металлов токсичны для живых организмов. Объясните механизм их токсического действия. Почему в качестве первой помощи при отравлении солями тяжелых металлов пострадавшему можно дать выпить сырой яичный белок?
40.В чем разница в первой помощи при отравлении угарным газом и нитритами?
41. Цитохром с содержит 0,426 % железа. Рассчитайте минимальную молярную массу этого белка.
42. После пожара обнаружен труп. Каким простым способом, проведя анализ крови, можно определить, погиб ли человек во время пожара или он умер до пожара?
43. Оптимальные условия действия амилазы – фермента, расщепляющего крахмал:
рН 6,8, t 37 °С. Как изменится активность фермента в каждом из следующих случаев:
1). рН инкубационной среды равен 5.
2). Температура инкубации 70 °С.
3). В инкубационную среду добавлен раствор сульфата меди (или сульфата свинца).
4). В присутствии раствора сульфата меди (или сульфата свинца) в среде увеличена концентрация крахмала?
Укажите причины изменения активности фермента.
44. Препарат, содержащий 2,0 мг аргиназы, за 10 мин при рН 9,0 катализировал образование 30 мкмоль мочевины. Рассчитайте удельную активность аргиназы. Как изменится активность фермента в каждом из следующих случаев:
1). Инкубационную среду подкислить до рН 5,0.
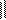 2). В среду добавить гликоциамин (NH2-C-NH-CH2-COOH).
2). В среду добавить гликоциамин (NH2-C-NH-CH2-COOH).
NH
3). В присутствии гликоциамина увеличить в среде концентрацию аргинина?
45. 0,05 мг трипсина за 15 мин образуют 100 мкмоль тирозина при оптимальных условиях инкубации: рН 8,0 и 37 °С. Рассчитайте удельную активность трипсина. Объясните, как и почему изменится активность трипсина, если:
1). рН инкубационной среды снизить до 3,0;
2). Температуру инкубационной среды повысить до 78 °С;
3). В инкубационную среду добавить трасилол (полипептид).
46. 1 мг фермента сукцинатдегидрогеназы за 5 мин катализирует окисление янтарной кислоты с образованием 10 мкмоль фумаровой кислоты при 37 °С и рН 7,0. Рассчитайте удельную активность фермента в оптимальных условиях. Объясните, как и почему изменится активность фермента, если:
1). рН инкубационной смеси 4,0.
2). К среде добавить малоновую кислоту.
3). В присутствии малоновой кислоты увеличить концентрацию янтарной кислоты.
47. 5 мг фермента лактатдегидрогеназы за 30 мин катализируют превращение пирувата с образованием 20 мкмоль лактата при 37 °С и рН 7,4. Как и почему изменится активность фермента, если:
1). рН инкубационной смеси 10,0.
2). Снизить концентрацию НАД+.
3). Температура инкубационной смеси 10 °С?
48. Холинэстераза при оптимальных условиях (37 °С и рН 8,4) в течение 15 мин катализирует гидролиз ацетилхолина с образованием 100 ммоль холина и уксусной кислоты. Рассчитайте активность фермента. Объясните, как и почему изменится активность фермента, если:
1) температуру инкубационной среды изменить от 5 до 40 °С.
2). рН среды уменьшить до 3,0
3). В инкубационную среду добавить прозерин:
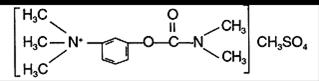 .
.
49. Фермент ацетилхолинэстераза катализирует гидролиз ацетилхолина – нейромедиатора, выделяющегося в синапсах холинергических нервов. Гидролиз ацетилхолина прерывается калимином – лечебным препаратом, используемым при двигательных нарушениях после травм, параличей, в восстановительном периоде после перенесенного полиомиелита, энцефалита и т.п. Ингибирование ацетилхолинэстеразы отражает следующая схема:
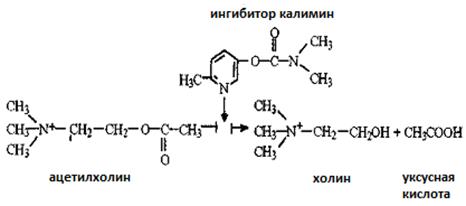
Сравните структурные формулы ингибитора и субстрата. Почему можно предположить, что ингибитор связывается в активном центре фермента? Как при действии калимина изменится проведение нервного импульса (увеличится, уменьшится, не изменится)?
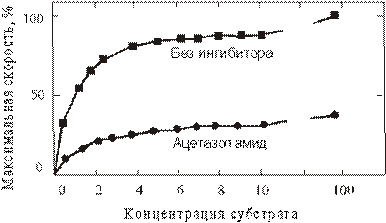
50. Известно, что карбоангидраза сильно ингибируется ацетазоламидом, применяемым как мочегонное средство и как препарат для лечения глаукомы, характеризующейся повышением внутриглазного давления. В этих и других секреторных процессах карбоангидраза играет важную роль, поскольку она участвует в регуляции рН и содержания бикарбоната во многих жидкостях организма человека. На рисунке показана экспериментальная кривая, выражающая зависимость скорости реакции, катализируемой карбоангидразой, от концентрации субстрата. При проведении опыта в присутствии ацетазоламида получается нижняя кривая. Исходя из анализа кривых и Ваших знаний о кинетических свойствах конкурентных и неконкурентных ингибиторов ферментов, определите природу ингибирования ацетазоламидом. Объясните, на чем основано Ваше утверждение.
51. Сладкий вкус зерен в свежесобранных початках кукурузы обусловлен высоким содержанием в них сахара. Кукуруза, которую продают спустя несколько дней после сбора, имеет более низкую сахаристость, так как около 50 % свободного сахара в зернах превращаются в крахмал в течение одного дня хранения. Чтобы сохранить сладкий вкус свежесобранной кукурузы, очищенные початки помещают на несколько минут в кипящую воду («бланшируют»), а затем охлаждают в холодной воде. Кукуруза, обработанная таким образом и хранящаяся в замороженном виде, сохраняет свой сладкий вкус. В чем биологическая основа этой обработки?
52.Метанол очень токсичен: прием внутрь всего 30 мл метанола может привести к смерти. Высокая токсичность метанола обусловлена действием не столько метанола, сколько продукта его метаболизма - формальдегида. Метанол быстро окисляется до формальдегида под действием фермента печени алкогольдегидрогеназы. Один из методов лечения при отравлении метанолом состоит в том, что больному назначают этанол либо внутрь, либо внутривенно в количествах, которые у здорового человека вызывают интоксикацию. Объясните, почему такое лечение оказывается эффективным.
53. После инкубации с n-хлоромеркуриобензоатом связывание фермента с субстратом не изменилось по сравнению с необработанным ферментом, но каталитическая активность фермента уменьшилась на 40 %. Какой вывод можно сделать из этого наблюдения?
54. Фермент глутаматдегидрогеназа катализирует реакцию превращения L-глутамата в α-кетоглутарат. Кинетические данные зависимости изменения начальной скорости реакции от концентрации L-глутамата приведены в таблице:
| Концентрация L - глутамата, ммоль/л | Начальная скорость (образование НАДН+Н+, единицы оптической плотности) |
| 1,68 3,33 5,00 6,67 10,00 20,00 25,00 30,00 | 0,127 0,250 0,286 0,303 0,334 0,384 0,385 0,385 |
Найдите Km и Vmax этой реакции путем построения классической зависимости по Михаэлису-Ментен и по методу Лайнуивера-Берка.
55. Гликоген - это полисахарид, состоящий из нескольких остатков глюкозы. Фермент гликогенсинтаза, ответственный за наращивание молекулы гликогена, катализирует реакцию:
УДФ - глюкоза + (глюкоза)n ® (глюкоза) n+1 + УДФ.
Кинетические данные зависимости изменения начальной скорости от концентрации УДФ - глюкозы приведены в таблице:
| Концентрация УДФ - глюкозы, ммоль/л | Начальная скорость, ммоль/мин |
| 0,8 1,4 3,3 5,0 6,0 | 10,0 12,5 22,0 25,00 25,3 |
Найдите Km и Vmax этой реакции путем построения зависимости начальной скорости от концентрации субстрата по Михаэлису-Ментен и по методу Лайнуивера-Берка.
56. Пенициллин гидролизуется бактериальным ферментом пенициллиназой. Кинетические данные зависимости изменения начальной скорости этой реакции от концентрации пенициллина приведены в следующей таблице:
| Концентрация пенициллина, М | Количество гидролизовавшегося пенициллина, моль/мин |
| 0,1·10-5 0,3·10-5 0,5·10-5 1,0·10-5 3,0·10-5 5,0·10-5 7,0·10-5 | 0,11·10-9 0,25·10-9 0,34·10-9 0,45·10-9 0,58·10-9 0,61·10-9 0,62·10-9 |
а) Постройте по этим данным график в обратных координатах. Подчиняется ли пенициллиназа кинетике Михаэлиса-Ментен? Если да, то чему равна Km этого фермента?
б) Чему равна Vmax?
57. Была определена скорость ферментативной реакции сукцинатдегидрогеназы в присутствии различных концентраций янтарной кислоты. Получены следующие данные:
| Концентрация сукцината, M | Скорость реакции, мкмоль/мин |
| 0,2·10-5 | 4.1 |
| 0,4·10-5 | 6.4 |
| 0,6·10-5 | 8,7 |
| 0,8·10-5 | 11,0 |
| 1,0·10-5 | 12,0 |
| 3,0·10-5 | 22,6 |
| 9,0·10-5 | 33,8 |
| 15,0·10-5 | 34,5 |
| 21,0·10-5 | 34,6 |
Определите значение Km сукцинатдегидрогеназы и Vmax.
58. Была определена скорость ферментативной реакции, катализируемой каталазой, в присутствии различных концентраций пероксида водорода. Получены следующие данные:
| Концентрация пероксида водорода, M | Скорость реакции, мкмоль/мин |
| 0,3·10-5 | 10,4 |
| 0,5·10-5 | 14,5 |
| 1,0·10-5 | 22,5 |
| 3,0·10-5 | 33,8 |
| 9,0·10-5 | 40,5 |
| 13,0·10-5 | 41,5 |
| 16,0·10-5 | 41,6 |
Чему равны Vmax данной реакции и Km каталазы?
59. Была определена скорость ферментативной реакции, катализируемой рибозимом, в присутствии различных концентраций РНК. Получены следующие данные:
| Концентрация РНК, M | Скорость реакции, мкмоль/мин |
| 0,1·10-4 | 1,3 |
| 0,3·10-4 | 2,1 |
| 0,5·10-4 | 2,9 |
| 0,7·10-4 | 3,5 |
| 1,0·10-4 | 4,5 |
| 3,0·10-4 | 6,8 |
| 9,0·10-4 | 8,1 |
| 15,0·10-4 | 8,5 |
| 18,0·10-5 | 8,6 |
Постройте по этим данным график Лайнуивера-Берка и определите значение Km для рибозима.
60. Измеряли кинетику ферментативной реакции лизоцима в зависимости от концентрации муреина, были получены следующие данные:
| Концентрация муреина, M | Скорость реакции, мкмоль/мин |
| 2,5·10-6 | |
| 4,0·10-6 | |
| 1,0·10-5 | |
| 2,0·10-5 | |
| 4,0·10-5 | |
| 1,0·10-4 | |
| 2,0·10-3 | |
| 1,0·10-2 |
Определите Km лизоцима и Vmax.
61. При определении каталитической активности пептидазы из тонкого кишечника, гидролизующей дипептид глицилглицин по схеме: глицилглицин + H2O → 2 глицин, были получены следующие экспериментальные данные:
| [S], мМ | 1,5 | 2,0 | 3,0 | 4,0 | 8,00 | 16,00 | 24,00 |
| V, мг/мин | 0,21 | 0,24 | 0,28 | 0,33 | 0,40 | 0,45 | 0,46 |
По этим данным определите графическим путем величины Km и Vmax для этого препарата фермента.
62. Измеряли кинетику ферментативной реакции в зависимости от концентрации субстрата в присутствии или в отсутствие ингибитора. Были получены следующие данные:
| [S], M | Скорость реакции, мкмоль/мин | |
| без ингибитора | с ингибитором | |
| 0,3·10-5 | 10,4 | 4,1 |
| 0,5·10-5 | 14,5 | 6,4 |
| 1,0·10-5 | 22,5 | 11,3 |
| 3,0·10-5 | 33,8 | 22,6 |
| 9,0·10-5 | 40,5 | 33,8 |
а) Чему равны Vmax и Km в отсутствие ингибитора и в присутствии его?
б) Каков тип ингибирования?
в) Чему равна константа связывания ингибитора?
63. Декарбоксилирование глиоксилата митохондриями ингибируется малонатом. При кинетическом исследовании были получены следующие результаты:
| Концентрация глиоксилата, мМ | Скорость выделения СО2 (условные единицы) | ||
| в отсутствие малоната | при концентрации малоната 1,26 мМ | при концентрации малоната 1,96 мМ | |
| 1,00 | 2,50 | 2,17 | 1,82 |
| 0,75 | 2,44 | 1,82 | 1,39 |
| 0,60 | 2,08 | 1,41 | 1,28 |
| 0,50 | 1,89 | 1,30 | 1,00 |
| 0,40 | 1,67 | 1,09 | - |
| 0,33 | 1,39 | - | - |
| 0,25 | 1,02 | - | 0,56 |
Является ли малонат конкурентным ингибитором?
64. Измеряли кинетику ферментативной реакции в зависимости от концентрации субстрата в присутствии или в отсутствие ингибитора. Получены следующие данные:
| [S], М | Скорость реакции, мкмоль/мин | |
| Без ингибитора | С ингибитором | |
| 0,3·10-5 | 10,4 | 4,1 |
| 0,5·10-5 | 14,5 | 6,4 |
| 1,0·10-5 | 22,5 | 11,3 |
| 3,0·10-5 | 33,8 | 22,6 |
| 9,0·10-5 | 40,5 | 33,8 |
а) Чему равны Vmax и Km в отсутствие ингибитора? В присутствии его?
б) К какому типу ингибирования относится данный случай?
65. Проведите различия между:
а) гидролазами и гидратазами,
б) фосфатазами и фосфорилазами,
в) экзопептидазами и эндопептидазами,
г) пепсином и катепсином,
д) трипсином и химотрипсином,
е) трипсином и трипсиногеном.
66. Выберите правильные парные сочетания ключевых слов или фрагментов фраз (обозначены буквами А, Б, В, Г, Д) и смысловых завершающих предложений (обозначены буквами а, б, в, г, д).
А. Оксидаза. Б. Дегидрогеназа. В. Каталаза. Г. Пероксидаза. Д. Гидратаза.
а) Ускоряет реакцию Н2О2 + АН2 ® 2Н2О + А
б) Катализирует превращение R-CH2-CH(OH)-R’ « R-CH= CH-R’ + Н2О
в) Ускоряет процесс АН2 + O2 ® A + Н2О
г) Обеспечивает каталитическое ускорение реакции: АН2 + B ® A + BH2
д) Каталитически повышает скорость реакции: 2Н2О2 ® 2Н2О + O2
67. Выберите правильные парные сочетания ключевых слов или фрагментов фраз (обозначены буквами А, Б, В, Г, Д) и смысловых завершающих предложений (обозначены буквами а, б, в, г, д).
А. Гидролаза. Б. Лиаза. В. Трансфераза. Г. Изомераза. Д. Оксидоредуктаза.
а) Катализирует превращение:
метилмалонил-КоА + пируват « пропионил-КоА + ЩУК
б) Ускоряет реакцию:
УДФ-глюкоза « УДФ-галактоза
в) Обеспечивает ускорение реакции:
ЩУК « ПВК + СО2
г) Каталитически ускоряет процесс:
H2N-CO-NH2 + Н2О « СО2 + 2NH3
д) Каталитически повышает скорость реакции:
лактат + НАД+ « НАДН + Н+
68.Изучалась устойчивость двух разных ферментов (гексокиназы и рибонуклеазы) к действию температуры. Выяснилось, что при нагревании ферментов при температуре 50 °С в течение 15 минут гексокиназа теряет 70 % своей активности, в то время как рибонуклеаза - только 30 %. При сравнении структурной организации этих ферментов выяснилось, что рибонуклеаза содержит в своей структуре 4 дисульфидные связи. Исходя из приведенных выше данных, объясните отличия в устойчивости двух ферментов к тепловой денатурации.
Вопросы к коллоквиуму «Биохимия белков и ферментов»
1. Предмет и задачи биологической и клинической химии. Понятие о биохимических реакциях.
2. Аминокислоты - структурные мономеры белков. Общая характеристика, классификация (полярные, неполярные, полярные незаряженные), свойства.
3. Специфичность первичной структуры белка. Особенности образования пептидной связи. Определяющая роль первичной структуры в формировании более высоких уровней организации белковой молекулы.
4. Вторичная структура белка. Связи, стабилизирующие вторичную структуру.
α-спираль. Факторы, нарушающие спирализацию. b-складчатая структура, особенности конформационного строения.
5. Третичная структура белка. Связи, стабилизирующие третичную структуру (ковалентные, ионные, гидрофобные, водородные, Ван-дер-Ваальса).
6. Четвертичная структура белка. Понятие о мономерах и олигомерах. Зависимость свойств белка от его конформации. Взаимосвязь структуры и функции.
7. Понятие «нативный белок». Понятие об аллостерических белках.
8. Основные функции простых и сложных белков в организме: структурная, каталитическая, рецепторная, регуляторная, транспортная, защитная, сократительная и другие.
9. Содержание белков в тканях и органах. Размеры белковой молекулы. Методы определения молекулярной массы белка (гель-фильтрация, ультрацентрифугирование, диск-электрофорез).
10. Растворимость белка в воде. Зависимость растворимости от аминокислотного состава белков. Физико-химические свойства водных растворов белков. Понятие об изоэлектрической точке.
11. Денатурация и ренатурация белков. Денатурирующие агенты (физические и химические). Использование явления денатурации в клинике. Реакции осаждения белка в водных растворах. Высаливание белков. Обратимость процесса. Использование высаливания в медицине.
12. Простые белки. Принцип их классификации. Глобулярные белки. Функции альбуминов и глобулинов плазмы крови. Особенности строения и функция гистонов и протаминов. Фибриллярные белки (миозин, коллаген, эластин, кератин).
13. Сложные белки, их классификация. Металлопротеины и их функция в организме.
14. Гемоглобин А, структура и функция. Аллостерические формы гемоглобина. Гемоглобинопатии. Структура, функциональное сходство и различие молекул гемоглобина и миоглобина.
15. Основные белки иммунной системы. Антитела. Т-рецепторы и белки главного комплекса гистосовместимости.
16. Нуклеиновые кислоты: ДНК и РНК, первичная и вторичная структура. Видовая специфичность нуклеиновых кислот. Нуклеопротеины, структура и функции.
17. Химическая природа, структура и функции ферментов, характеристика кофакторов и коферментов, их роль в катализе.
18. Понятие об активных центрах ферментов. Аллостерический центр. Аллостерические ферменты.
19. Изоферменты. Мультимолекулярные ферментные системы. Единицы ферментативной активности.
20. Механизм действия ферментов.
21. Классификация ферментов. Примеры.
22. Кинетика ферментативных реакций. Сродство между субстратом и ферментом. Понятие о константе Михаэлиса. Уравнение Михаэлиса-Ментен.
23. Регуляция активности ферментов. Активаторы и ингибиторы ферментов. Типы ингибирования ферментов: обратимое и необратимое; конкурентное и неконкурентное.
24. Влияние рН и температуры на скорость ферментативных реакций. Специфичность действия ферментов.
25. Значение ферментов в регуляции обмена веществ. Применение ферментов в медицине.
