Систематическая (ИЮПАК) номенклатура
В настоящее время основной является систематическая (июпак) номенклатура. В основу названий соединений по этой номенклатуре положено название самой длинной углеродной цепи, содержащей максимальное число кратных связей, а если таких цепей несколько, то выбирается самая разветвленная из них. Все углеводородные остатки (радикалы), не вошедшие в главную цепь, перечисляются в названии соединения в порядке старшинства перед названием главной цепи. Для обозначения места присоединения радикалов к главной цепи вводится нумерация цепи.
Цифрами обозначается также место расположения кратных связей вдоль цепи. Нумерация главной цепи начинается с того ее конца, где сумма мест кратных связей будет минимальной при наличии одной кратной связи в соединении; это положение сводится к поиску конца цепи, к которому кратная связь расположена ближе.
Если в соединении имеется несколько одинаковых заместителей, то во избежание повторения радикалов употребляются частицы удвоения (ди-), утроения (три-), учетверения (тетра-) и т. д., которые помещают перед названием радикалов. Цифры, показывающие места присоединения заместителей, всегда должны помещаться перед их названиями. Нумерация цепи обязательно начинается с первичного атома углерода.
Пример 2.
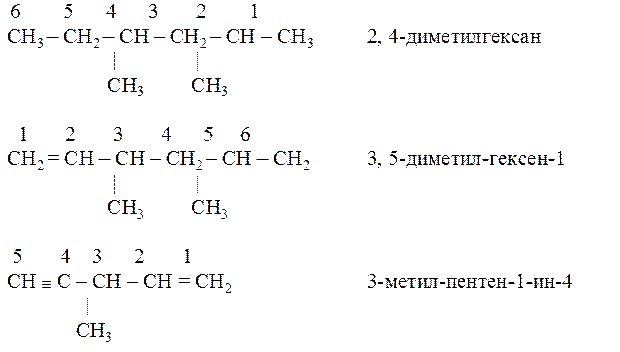
Названия радикалов образуют путем замены окончания -ан, предельных углеводородов на -ил. Они имеют общее название -алкилы и обозначаются R–. Радикал называют первичным, если свободная валентность принадлежит первичному атому углерода; вторичным, если свободная валентность принадлежит вторичному атому углерода; третичным – соответственно третичному атому углерода.
Пример 3.
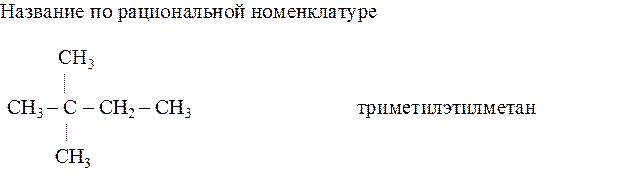
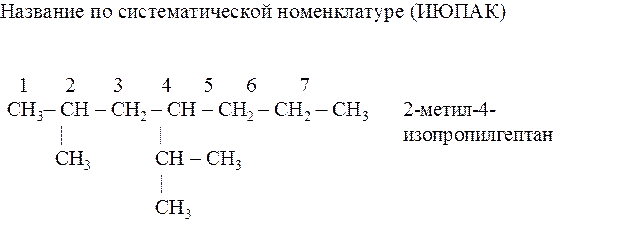
Чтобы получить название по международной номенклатуре ИЮПАК, следует выполнить такую последовательность действий: 1) выбрать самую длинную углеродную цепь, пронумеровать ее. Нумерацию следует начинать с того конца, ближе к которому расположены заместители в боковой цепи; 2) цифрой указать углеродные атомы, у которых находятся заместители. Назвать эти заместители. Если в формуле несколько одинаковых заместителей, то перед их названием указывается число прописью (ди, три, тетра), а номера заместителей разделяют запятыми; 3) назвать углеводород, который взят за основу (т. е. пронумерован) с окончанием ан, например
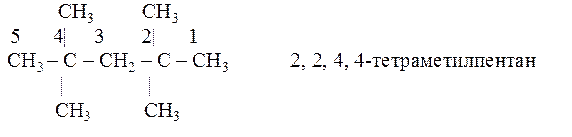
ЗАДАЧИ
21.1. Составить полные структурные формулы изомеров, имеющих состав С5Н12.
21.2. Составить полные структурные формулы изомеров С7Н16.
21.3. Составить полные структурные формулы изомеров С6Н14.
21.4. Составить полные структурные формулы изомеров С8Н18.
21.5. Какие из приведенных ниже веществ являются изомерами?
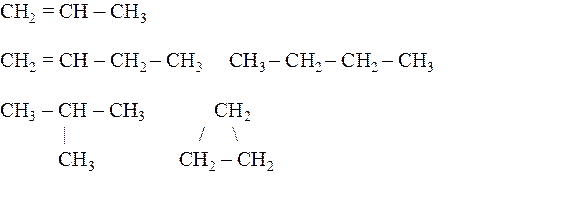
21.6. Какие из написанных формул органических соединений являются изомерами?
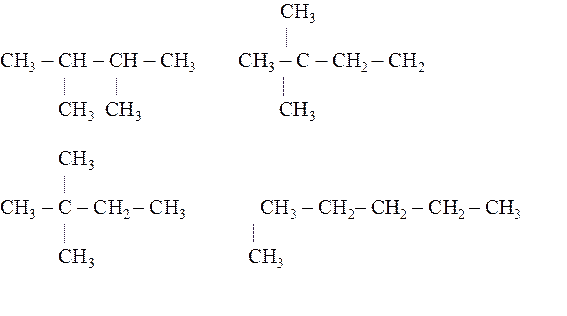
21.7. Составить полные структурные формулы изомеров С9Н20.
21.8. Изобразить структурные формулы изомеров гексана и назвать их.
21.9. Изобразить структурные формулы изомеров гептана и назвать их.
21.10. Изобразить структурные формулы изомеров октана и назвать их.
21.11. Назвать по системе ИЮПАК следующие алканы:
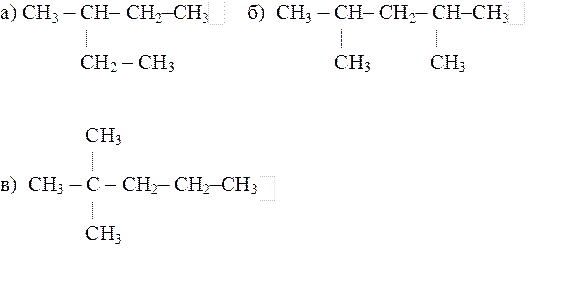
21.12. Написать структурные формулы соединений по их названиям: а) 3,3-диэтилгептан; б) 2-метилгексан; в) 2-метил-4-изопропилнонан; г) 1,4-диметилциклогексан.
21.13. Указать первичные, вторичные, третичные и четвертичные атомы углерода в следующих соединениях:
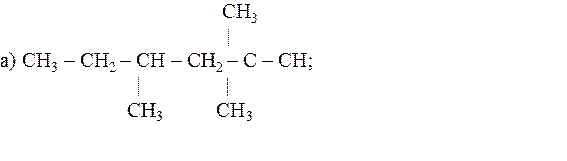
б) 2,3-диметил-3-этил-5-изопропилоктан.
21.14. Определить, сколько изомеров имеет нонан и назвать их по системе ИЮПАК.
21.15. Какие из перечисленных ниже алканов являются изомерами: а) 2-метилгексан; б) 3-метилгептан; в) 3-этилгексан; г) 2,2-диметилгептан; д) 2,4-диметилгексан.
21.16. Какие из перечисленных ниже алканов являются изомерами: а) 2,4-диметилгексан; б) 2-метилоктан; в) 3,3-диэтилгептан; г) 2-метилгексан; д) 2,5-диметилгексан.
21.17. Написать формулы изомерных углеводородов, состав которых отвечает эмпирической формуле С5Н10.
21.18. Написать формулы изомерных углеводородов, состав которых отвечает эмпирической формуле С6Н12.
21.19. Написать формулы изомерных углеводородов, состав которых отвечает эмпирической формуле С5Н10.
21.20. Написать структурные формулы следующий алкенов: а) 3-метилпентен-2; б) 4,4-диметил-3-этилгексен-1; в) 4-изопропилгептен-2.
21.21. Сколько изомеров алкенов соответствует формуле С7Н14? Изобразить их структурные формулы и назвать их по системе ИЮПАК.
21.22. Написать структурные формулы следующих алкенов: а) 3-метилпентен-2; б) 4,4-диметил-3-этилгексен-1; в) 4-изопропилгептен-2.
21.23. Написать структурные формулы следующих соединений: а) 3,3-диметилбутин-1; б) 2,5-диметилгексин-3; в) 4-метил-5-этилоктин-2.
21.24. Написать структурные формулы изомеров алкинов состава С5Н8. Назвать их по системе ИЮПАК.
21.25. Написать структурные формулы изомеров алкинов состава С6Н10. Назвать их по системе ИЮПАК.
21.26. Написать структурные формулы изомеров алкинов состава С7Н12. Назвать их по системе ИЮПАК.
21.27. Написать структурные формулы следующих соединений: а) пентадиен-1,4; б) 2,3-диметилгексадиен-2,4; в) 3-изопропилгексадиен-1,3.
21.28. Назвать следующие алкины по системе ИЮПАК:
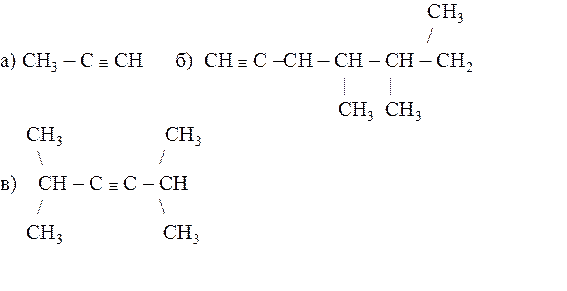
21.29. Назвать по системе ИЮПАК следующие соединения:
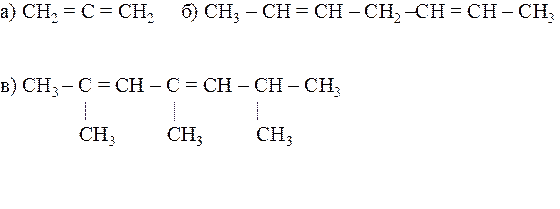
21.30. Назвать по системе ИЮПАК следующие соединения:
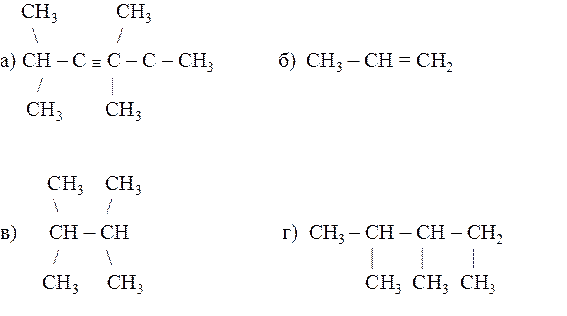
Раздел 22. Высокомолекулярные соединения (полимеры)
Высокомолекулярные соединения (ВМС) – это химические вещества с большой молекулярной массой и обладающие особыми свойствами. ВМС часто называют полимерами.
Макромолекулы полимеров построены из одинаковых, многократно повторяющихся групп атомов – элементарных звеньев, связанных между собой. ВМС получают методом полимеризациии поликонденсации.
Процесс последовательного соединения одинаковых молекул (мономеров) в более крупные (полимеры) называется полимеризацией. Число элементарных звеньев в макромолекуле полимера (n) является одной из главных характеристик полимера и называется степенью полимеризации (n) полимера. Между этой величиной и молекулярной массой полимера существует соотношение n = М / m, где М – молекулярная масса полимера; m – молекулярная масса элементарного звена.
В зависимости от условий, в которых протекает процесс (температуры, давления, катализатора и т. д.), n может принимать значения 500–10000.
Реакция полимеризации пропилена
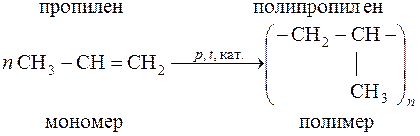
Полимеры с высокой степенью полимеризации называются высокополимерами, а с небольшой – олигомерами. В реакциях поликонденсации соединения молекул мономеров в макромолекулу сопровождаются выделением простых веществ (Н2O, NH3, HCl) и образованием новых групп, отсутствующих в молекулах мономера.
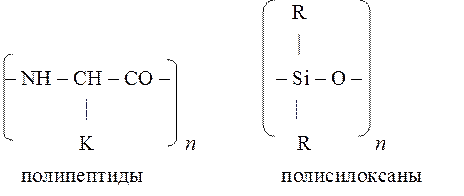
Для проведения реакции поликонденсации в исходных продуктах необходимо наличие функциональных групп (–NH2, –OH, –COOH и др.).
H2N–(CH2)5–COOH + H2N–(CH2)5–COOH ® (–HN–(CH2)5–CO–)n + nH2O
аминокапроновая кислота поликапроамид
В результате полимеризации и поликонденсации могут быть получены различные соединения с заранее заданными свойствами.
Полимеризация может протекать по радикальному, катионному и анионному механизмам.
В зависимости от характера размещения элементарных звеньев в цепи полимера различают регулярные и нерегулярные полимеры. Регулярность выражается в правильно повторяющемся расположении атомов в макроцепи.
Например, полимеризация пропилена может дать несколько типов продуктов, различающихся расположением метильных групп в пространстве. Если все метильные группы расположены по одну сторону от плоскости цепи, изомер называется изотактическим. Если все метильные группы расположены по обе стороны от плоскости цепи полипропилена, то он называется синдиотактическимили стереорегулярным. Если расположение боковых групп беспорядочно, изомер называется атактическим.
В зависимости от формулы макромолекул ВМС бывают не только линейными, но и разветвленными и пространственными (трехмерными). Из природных полимеров линейное строение имеют целлюлоза, натуральный каучук, из синтетических – полиэтилен, поливинилхлорид и др.
Разветвленные полимеры имеют длинные цепи с боковыми ответвлениями:
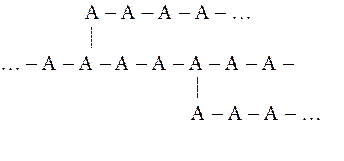
Пространственные (трехмерные) полимерыпостроены из соединенных между собой макромолекулярных цепей. В качестве «мостиков», осуществляющих поперечную химическую связь, могут выступать отдельные атомы (группы атомов):
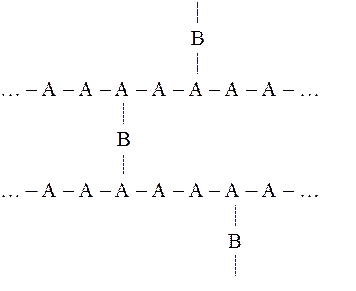
Такие полимеры называются сетчатыми. Это, прежде всего, мочевиноформальдегидные и фенолформальдегидные полимеры, резина и др.
Если в полимерные соединения ввести наполнители, красители, пластификаторы, то получаются пластмассы.
По методам получения все ВМС подразделяются на три группы: природные (белки, целлюлоза), синтетические (полиэтилен, поливинилхлорид) и искусственные, полученные путем химической модификации природных полимеров (эфиры целлюлозы).
По отношению к воздействию тепла ВМС делят на термопластичные и термореактивные.
Термопластичные полимерыспособны размягчаться при нагревании и вновь затвердевать при охлаждении, сохраняя все свои свойства.
Термореактивные полимерыпри повышении температуры становятся пластичными, но, затвердевая (под воздействием катализаторов, отвердителей) переходят в неплавкое, нерастворимое состояние.
В процессе эксплуатации изделий из полимерных материалов, а также при переработке полимеров происходит их разрушение – деструкция. Деструкция является одним из видов «старения» полимеров и представляет собой необратимую химическую реакцию, приводящую к нежелательным изменениям в структуре полимеров. Это необходимо учитывать при использовании ВМС в строительных технологиях.
Различают деструкцию химическая (под влиянием химических реагентов), механическую (при механических напряжениях), окислительную (воздействие окислителей), термическую (при нагревании полимеров), фотохимическую (вследствие освещенности), радиационную (действие a-, b-, g- и других видов излучений), биологическую (действие биологических факторов).
ВМС могут находиться в двух агрегатных состояниях: твердом и жидком.
По характеру поведения под воздействием механических нагрузок все ВМС делятся на три большие группы:
1) текучие полимеры, имеющие аморфное строение и необратимо изменяющие свою форму (полиизобутилен, фенолоформальдегидные полимеры – резолы).
2) высокоэластичные (эластомеры), имеющие аморфное строение (каучуки, резина), обратимо деформируемые под воздействием небольших нагрузок.
3) твердые полимеры, имеющие аморфное или кристаллическое строение и мало изменяющие свою форму.
Аморфныеполимеры могут пребывать в трех физических состояниях: твердом (стеклообразном), высокоэластичном и вязкотекучем. При нагревании или охлаждении один и тот же полимер может переходить из одного физического состояния в другое. Например, полиизобутилен при комнатной температуре находится в высокоэластичном состоянии, при нагревании переходит в вязкотекучее, а при охлаждении – в стеклообразное.
Наличие большого температурного интервала между твердым и вязкотекучим состояниями (до 150 °С) – отличительная особенность полимерных материалов.
По химическому составу основной макромолекулярной цепи ВМС делятся на два больших класса: гомоцепные (карбоцепные), цепи которых построены из одинаковых атомов, и гетероцепные, цепи которых построены из атомов различных элементов.
К первым относятся
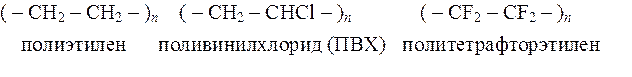
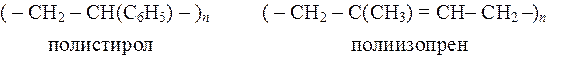
к гетероцепным относятся
ЗАДАЧИ
22.1. ВМС и их использование в строительных технологиях.
22.2. Что такое полимер, мономер, степень полимеризации?
22.3. Что показывает степень полимеризации?
22.4. Основные способы получения ВМС?
22.5. Что называется функциональной группой органических соединений?
22.6. Назвать природные ВМС (полимеры).
22.7. Назвать наиболее широко применяемые синтетические полимеры.
22.8. Написать уравнение реакции полимеризации: а) 2-метилпропена; б) 3,3-диметилбутена.
22.9. Написать уравнение реакции поликонденсации фенола и формальдегида.
22.10. Определить молекулярную массу полиизобутилена, если степень полимеризации изобутилена (2-метилпропена) равна 1200.
22.11. Определить степень полимеризации этилена (этена) при получении полимера с молекулярной массой 1400.
22.12. Составить уравнение реакции полимеризации стирола.
22.13. Составить уравнение реакции получения изопренового каучука (полимеризация изопрена).
22.14. Чему равна степень полимеризации бутадиен-нитрильного каучука? Средняя молекулярная масса его равна 395000.
22.15. Написать уравнение реакции полимеризации бутадиена-1,3 (получение бутадиенового каучука).
22.16. Составить уравнение реакции получения поливинилхлорида.
22.17. Как определяется молекулярная масса полимера?
22.18. По какому механизму может протекать реакция полимеризации?
22.19. Сформулировать определение регулярных полимеров.
22.20. Сформулировать определение нерегулярных полимеров.
22.21. Стереорегулярные полимеры.
22.22. Привести примеры линейных, разветвленных и пространственных полимеров.
22.23. На какие группы по отношению к механическим нагрузкам делятся ВМС?
22.24. Сформулировать понятие термопластичности и термореактивности ВМС.
22.25. Назвать основные виды деструкции полимеров.
22.26. Написать уравнение реакции получения поливинилового спирта.
22.27. Написать уравнение реакции получения поливинилацетата (ПВА).
22.28. Написать уравнение реакции получения хлоропренового каучука.
22.29. Дать характеристику трех типов конфигураций полимерных молекул (изотактический, синдиотактический, атактический).
22.30. Привести примеры использования природных полимерных материалов в современных строительных технологиях.
Рекомендуемая литература
1. Химия: учеб. пособие / под ред. В. В. Денисова. – М.: ИКЦ «МарТ», 2003. – 464 с.
2. Глинка, Н. Л. Задачи и упражнения по общей химии: учеб. пособие для вузов / Н. Л. Глинка; под ред. В. А. Рабиновича, Х. М. Рубиной. При участии Т. Е. Алексеевой, Н. Б. Платуновой, В. А. Рабиновича, Х. М. Рубинной, Т. Е. Хрипуновой. – М.: Интеграл-Пресс, 2008. – 240 с.
3. Шиманович, И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович, 3-е изд., испр. – М.: Высшая школа, 2003. – 128 с.
4. Химия: метод. указания к лабораторным работам для студентов всех специальностей. / Сост.: Л. И. Акимов, Н. А. Андреева, М. Д. Бальмаков, И. В. Гончарова, В. В. Инчик, А. М. Миронов, А. И. Павлов, А. В. Ухина, О. М. Халина; СПбГАСУ. Под ред. Л. И. Акимова. – 2-е изд., перераб. и доп. – СПб., 2007. – 73 с.
5. Гончарова И. В. Двухкомпонентные диаграммы состояния – универсальный метод изучения сплавов и силикатных систем: учеб. пособ. для студ. I курса всех спец. и III курса спец. 290600 / И. В. Гончарова, Н. А. Андреева / СПб. гос. архит.- строит. ун-т. – СПб., 2006. – 50 с.
6. Инчик, В. В. Строительная химия: учеб. пособие / В. В. Инчик; СПб. гос. архит.-стр. ун-т. – М.: АСВ; СПб.: СПбГАСУ, 1995. – 128 с.
7. Классификация и номенклатура органических соединений: учебное пособие для студентов всех специальностей / А. В. Ухина; СПбГАСУ. – СПб., 2005. – 24 с.
8. Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономаревой. – Л.: Химия, 1983. – 200 с.
ПРИЛОЖЕНИЕПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ
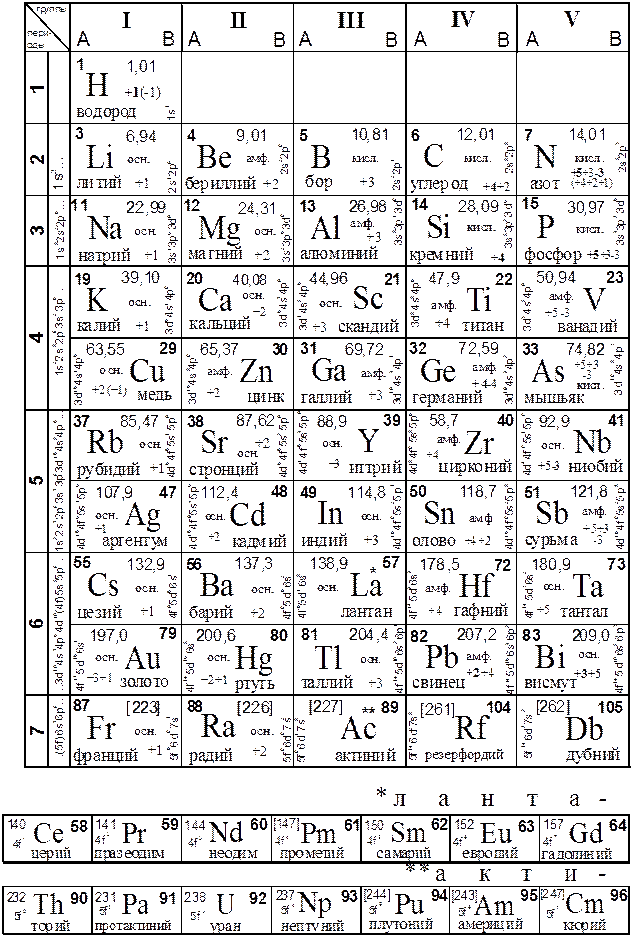
ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА Таблица 1
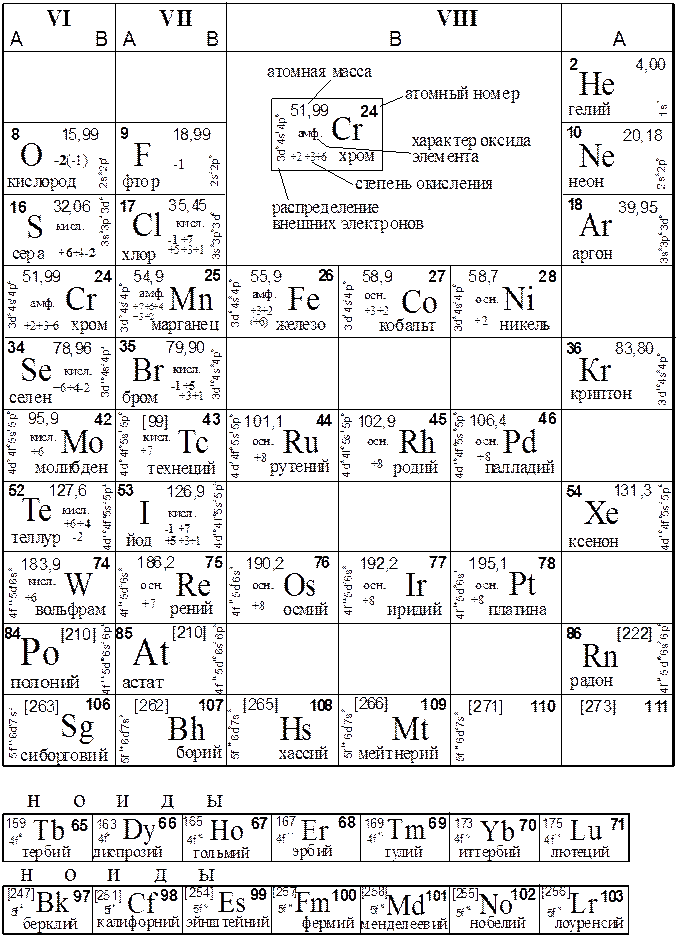
Таблица 2
