Объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа.
5. Закон Авогадро
формулируется так:
В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
Следствие из закона:
1 моль (6,02×1023 молекул – число Авогадро) любого газа при нормальных условиях занимает объем 22,4 л. Эта величина называется молярный объём.
Vm = 22,4 л,
Нормальными условиями (н.у.) считают температуру 0оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па).
6.Следствия из закона Авогадро
Из закона Авогадро следует, что массы двух газов (m1 и m2), взятых в одинаковых объёмах, должны относится друг к другу, как их как их молекулярные массы или как численно равные их молярные массы (M1 и M2):
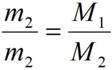 .
.
Отношение массы одного газа к массе другого газа, взятого при тех же условиях (температуре и давлении), называется относительной плотностью первого газа по второму.
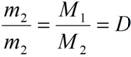 ,
,
откуда
М1=DM2.
Взаимосвязь молярной массы, молярного объёма, числа Авогадро и количества вещества:
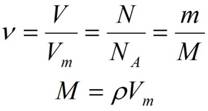 ,
,
7.Атомные и молекулярные массы
Относительной атомной массой химического элемента называется величина, показывающая во сколько раз масса данного атома больше 1/12 массы атома углерода.Она обозначается буквой Аr. Относительные атомные массы указаны в периодической таблице.
Относительной молекулярной массой вещества называется величина, показывающая во сколько раз масса молекулы больше 1/12 массы атома углерода. Она обозначается Мr. Относительная молекулярная масса складывается из суммы атомных масс атомов, составляющих молекулу, с учётом числа атомов.
8.Относительная молекулярная масса. Моль
Введём ещё одну величину - количество вещества, которое измеряется в молях.
Моль-это количество вещества, содержащее столько структурных единиц(атомов, молекул, ионов), сколько атомов содержится в 12 г углерода. Обозначается буквой ν(ню)
Зная массу атома углерода 1,993·10-26 кг можно вычислить число атомов в 0,012 кг углерода:
NA=0,012/1,993·10-26=6,02·1023
Это число называется постоянной Авогодро и обозначается NA, размерность 1/моль или моль -1,и показывает число структурных единиц в моле любого вещества. Т.е. 1 моль любого вещества содержит одинаковое число структурных единиц 6,02·1023. Используя эту величину можно определить количество вещества по формуле:
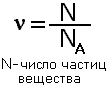
9.Молярная масса и молярный объем
С числом частиц работать трудно, поэтому вводится понятие молярная масса, которая показывает чему равна масса 1 моль конкретного вещества.Молярная масса равна отношению массы вещества к количеству вещества, обозначается буквой М.
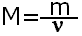
Молярная масса рассчитывается так же как и относительная молекулярная масса, но в отличии от неё имеет размерность г/моль. Например М(H2SO4)=1·2+32+16·4=98г/моль.Это означает, что масса 1 моль серной кислоты равна 98 г.
Ещё интересно то, что один моль любого газообразного вещества занимает объём 22,4 литра. Эта закономерность была установлена итальянским учёным Амадео Авргадро. Для газов можно использовать величину молярный объём, который обозначается буквой Vm,Vm=22.4 моль/л.
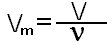
где V-объём газа в л.
10.Эквивалент. Закон эквивалентов
