Амфотерность. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
Соединения, молекулы которых способны при одних и тех же условиях отщеплять и ион Н и ион гидроксила ОН, наз. амфотерными. К ним относятся переходные Ме, а также Be,Al,Pb,Sn и др.
Zn(OH)2+ HCl=ZnCl2+2H2O
Zn(OH)2+2NaOH=Na2ZnO2+2H2O
Водородный показатель (рН) – это десятичный логарифм концентрации водородный ионов, взятый с обратным знаком.
| Нейтральная | [H+]=[OH-]; | [H+] =10-7 | pH = 7 |
| Кислая среда | [H+]>[OH-]; | [H+] >10-7 | pH < 7 |
| Основная среда | [H+]=[OH-]; | [H+] =10-7 | pH > 7 |
Индикаторы – специальный реактив, окраска которых меняется в зависимости от концентрации ионов водорода.
| Название индикатора | Цвет индикатора в различных средах | ||
| в кислой | в нейтральной | в щелочной | |
| Метиловый оранжевый Метиловый красный Фенолофталеин Лакмус | Красный(pH<3,1 ) Красный (pH<4,2) Бесцветный (pH<8) Красный (pH<5) | Оранжевый (3,1<pH<4,4) Оранжевый (4,2<ph<6,3) Бледно-малиновый (8<pH<9,8) Фиолетовый (5<pH<8) | Желтый (ph>4,4) Желтый (pH>6,3 ) Малиновый (pH>9,8) Синий (pH>8) |
Буферные растворы – те рас-ры, рН к-ых остается постоянным при разбавлении р-ра или при добавлении сильной к-ты или щёлочи небольшое кол-во. Кислотные буферы – р-р слабой к-ты и соли этой к-ты. [Н+] (кислотный буфер) = Кдисс [конц. кислоты]/ [конц. соли]
Основные буферы – р-ры слабого основания и соли этого основания.
Буферное действие – сво-во р-ов сохранять неизменным [Н+] при добавлении небольшого кол-ва кис-т или щелочей
Буферная емкость – предельное кол-во сильной к-ты или щелочи, к-ые нужно добавить в 1 л р-ра, стоюы изменить величину рН на 1 единицу.
Билет 28.
1. Ковалентая связь. Основные положения метода молекулярных орбиталей.
Ковалентная связь- хим. связь между двумя атомами, осуществляемая общей для этих атомов парой электронов. Неполярная (между атомами неметаллов с одинаковой элеткроотрицательностью) полярная (между атомами неметаллов с разной электроотрицательностью). Связь становится полярной когда один из атомов перетягивает к себе общую эл пару.
Свойства ковалентной связ:1)ковалентная связь насыщенная, это значит что между атомами ограниченное число связей; 2)Связь направлена по оси ох, оу, оz;(Направленность связи. Образование ковалентной связи взывается перекрыванием электронных облаков взаимодействующих атомов. Но такое перекрывание возможно только при определенной взаимной ориентации электронных облаков; при этом область перекрывания располоагется в определенном направлении по отношению к взаимодействующим атомам.) 3)Связь поляризуемая - деформируется во внешнем эл.поле.
Ковалентные соединения
Газообразные, жидкие или тв в-ва с низкой температурой плавления <300*С; многие не растворяются в полярных растворителях, большиноство растворимы в неполярных растворителях; р-ры и р-вы не проводят электричество.
Исходные положения метода МО: 1)вся молекула рассматривается как единое це-лое, состоящее из ядер (бывших атомов) и электронов (ранее принадлежавших ато-му); 2)все эл. являются общими для всех ядер, то есть хим.связи являются много-центровыми и каждая связь простирается между всеми ядрами в той или иной сте-пени. Таким образом с точки зрения мето-да МО двух центровая связь представляет собой частный случай многоцентровой хим.связи. 3) Состояние эл. в молекуле описывается с решением соответствуешего уравнения Шреденгера для молекулярной системы.4) у каждой МО своя энергия. 5) энергия МО будет наименьшей если атомное облако перекрыавются максимально.
МО бывают трех типов:связывающие(образуются в результате перекрывания ат.орбиталей двух соседних атомов), несвязывающие, разрыхляющие.
Метод молекулярных орбиталей используется для описания ковалентной связи. Молекулярная обиталь – алгебраическая сумма (линейная комбинация) атомных обиталей.
2.Цепные реакции
3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
Теория Аррениуса: Кислоты- электролиты, при дисс-ции (ионизации) к-ых образуются катионы водорода (протоны) и анионы кис-го остатка. HnK = nH+ + Kn- Примеры: HCl = H+ + Cl-
Важно: Следует отметить, что многоосновные кислоты диссоциируют ступенчато!
Основания- электролиты, при диссоциации которых образуются катионы металла (или аммония) и гидроксид-анионы. Me(OH)n = Men+ + nOH- Примеры: NaOH = Na+ + OH- Важно: Многокислотные основания так же как многоосновные кислоты диссоциируют ступечато!
Вывод: согласно теории Аррениуса кислотные свойства обусловлены отдачей молекулой вещества протонов, а основные свойства отдачей гидроксо-анионов. Взаимодействие кислоты и основания при этом сводится к связывании протонов и гидроксо-анионов в молекулы воды. H+ + OH- = H2O
Теория Бренстеда-Лоури (протонная теория, теория сопряженных кислот-оснований
Кислоты- вещества, способные отщеплять протоны. Основания- вещества, способные принимать протоны.
При взаимодействии кислоты и основания, кислота отдаёт свои протоны, а основание их принимает (связывает). При этом кислота переходит в сопряжённое её основание (более слабое), а основание переходит в сопряжённую ему кислоту (более слабую).
Кислота + Основание = Сопряжённая кислота + Сопряжённое основание
HCl + H2O = H3O + Cl-
кис-та основание сопряж. кис-та сопряж. основание
Теория Льюиса (Электронная Теория Кислот-Оснований) Кислота- вещество, способное принять электронную пару с образованием ковалентной связи (акцептор неподелённой электронной пары, кислота Льюиса). Основание- вещество, способное предоставить электронную пару для образования ковалентной связи (донор неподелённой электронной пары, основание Льюиса).
Взаим-ие кислоты с основанием сводится к перераспределению между ними электронных пар.
К примеру протон является кислотой, поскольку ему не хватает электронов и требуется электронная пара для образования устойчивой электронной оболочки.
Аммиак является основанием, так как на атоме азота имеется неподелённая электронная пара.
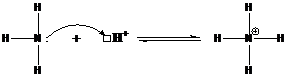
Билет 30
