Осмос. Осмотическое давление растворов, закон Вант-Гоффа.
Процесс односторонней диффузии растворителя через полупроницаемую перегородку называется осмосом.
Диффузия – стремление вещества равномерно распределиться по всему предоставленному ему объёму.
Можно создать условия, при которых может происходить диффузия только растворителя. Разделим раствор и растворитель пленкой, через которую проходят молекулы растворённого вещества. Такая пленка называется полупроницаемой перегородкой. В этом случае возможна только диффузия растворителя в раствор.
Если на конце стеклянной трубки сделать такую перегородку, обернув трубку, например, целлофаном, и, опустив её в воду, налить внутрь трубки какой-нибудь раствор, например сахара, то вследствие осмоса вода начнёт диффундировать в раствор. Для того, чтобы получилась полностью гомогенная система, вся вода должна перейти в раствор. Однако по мере диффузии воды объём раствора возрастает и давление на перегородку со стороны раствора увеличивается. Таким образом возникает сила – гидростатическое давление, препятствующая диффузии растворителя, и по достижении некоторого давления наступает равновесие: сколько молекул воды диффундирует в раствор, столько же выталкивается обратно увеличившимся давлением.
Равновесное давление раствора, препятствующее диффузии растворителя через перегородку, называется осмотическим давлением.
Вант-Гофф показал, что для разбавленных молекулярных растворов независимо от природы растворённого вещества и растворителя
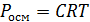
Где Pосм – осмотическое давление, С – молярная концентрация раствора, T – абсолютная температура, R – константа, совпадающая с универсальной газовой постоянной.
Закон Вант-Гоффа:
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворённое вещество, если бы при данной температуре оно в виде газа занимало объём раствора.
Электродные потенциалы.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K. Протекает следующая реакция: 2Н+ + 2e− = H2
ЭДС гальванического элемента может быть представлена как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродов. Зависимость электродного потенциала от концентраций веществ выражается уравнением Нернста:
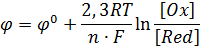
Здесь φ0 – стандартный электродный потенциал; R – газовая постоянная; T – абсолютная температура; F – постоянная Фарадея (96500Кл/моль); n – число электронов, участвующих в электродном процессе; [Ox] и [Red] – произведения концентраций веществ, принимающих участие в соответствующей полуреакции в окисленной и восстановленной формах.
Если пластину металла, погруженного в раствор его соли с концентрацией 1 моль/л, соединить в гальванический элемент с водородным электродом, то возникшая разность потенциалов называется стандартным электродным потенциалом металла и обозначается как E°.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов.
Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
1) Каждый металл может вытеснять (восстанавливать) из растворов их солей те металлы, которые стоят в ряду напряжений после него.
2) Все металлы, имеющие отрицательный электродный потенциал (то есть те, которые стоят в ряду напряжений до водорода), могут вытеснять (восстанавливать) его из растворов кислот.
Как нетрудно догадаться, понятие стандартного электродного потенциала приложимо не только к системе металл/ион металла, но и к любой реакции, проходящей с участием электронов.
