Осмос. Осмотическое давление, закон Вант-Гоффа.
Осмос - односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора с низкой концентрацией в раствор с более высокой концентрацией.
Осмотическое давление росм. – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить явление осмоса:
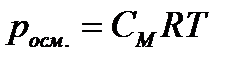
СМ – молярная концентрация раствора, моль/л
R = 8,31 Дж/моль·К, универсальная газовая постоянная
Т- температура, К.
Данные законы справедливы для идеальных растворов или растворов неэлектролитов, в растворах электролитов следует учесть диссоциацию молекул на ионы, т.к. для них не выполняются законы Рауля и Вант-Гоффа.
Для учета этих отклонений Вант-Гофф внес в уравнения поправку для растворов электролитов:
i – изотонический коэфициэнт.
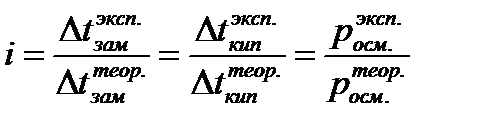
Изотонический коэффициэнт, как поправку вводят в уравнения свойств растворов. Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул:
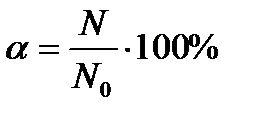
α – степень диссоциации
N – число молекул, распавшихся на ионы, N0 – общее число молекул
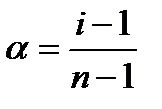
n – число ионов, на сколько диссоциирует молекула. Например для реакции:
CaCl2 → Ca2+ + 2Cl¯, n=3.
Примеры решения задач.
1. Вычислите понижение температуры замерзания раствора, если в 200 г бензола растворили 15 г гексана (C6H14), криоскопическая постоянная бензола - Ккр =5,07 К·кг/моль.
| Дано: mрастворителя=200г (C6H6) mр. в-ва=15г (C6H14) Mр. в-ва =86г/моль (C6H14) Ккр =5,07 К·кг/моль(C6H6) Δt - ? | Решение: 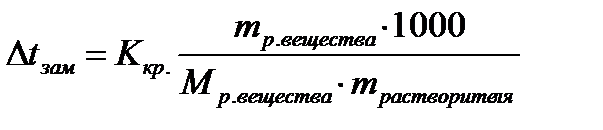 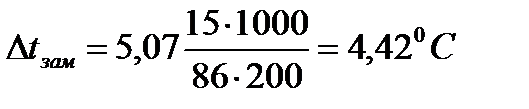 |
Аналогично решаются задачи на вычисление повышения температуры кипения и вычисления молярной массы растворенного вещества.
2. Вычислите осмотическое давление раствора при температуре 20ºC, если в 1 литре раствора содержится 50 г глюкозы (C6H12О6).
| Дано: Vраствора=1л = 1·10-3 м3 mр. в-ва=50г (C6H12О6) Mр. в-ва =180г/моль (C6H12О6) t = 20ºC; 293 К R = 8,31 Дж/моль·К росм. -? | Решение: 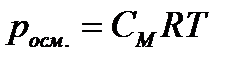 ; ; 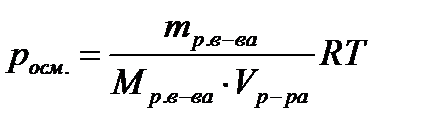 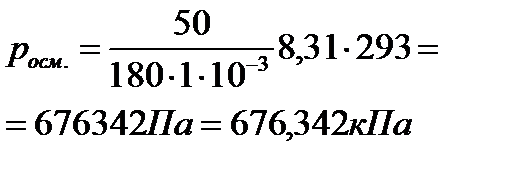 |
3. При растворении в 600 г воды 20 г хлорида кальция экспериментальное значение понижения температуры замерзания раствора составило 1,3оC, криоскопическая постоянная воды – Ккр =1,86 К·кг/моль. Вычислить степень диссоциации хлорида кальция.
| Дано: mрастворителя=600г mр. в-ва=20г (CaCl2) Mр. в-ва =112г/моль (CaCl2) Ккр =1,86К·кг/моль(H2O) Δtзам. (экспер.)=1,3ºC α - ? | Решение: Найдем теоретическое значение температуры замерзания раствора: 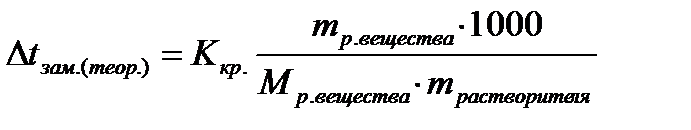 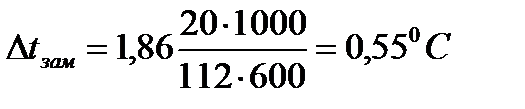 |
Изотонический коэффициент равен: 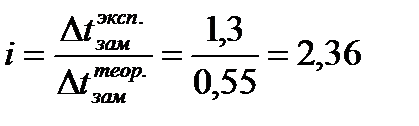 ; n =3 (число ионов, образующихся при диссоциации молекулы хлорида кальция). Степень диссоциации равна: ; n =3 (число ионов, образующихся при диссоциации молекулы хлорида кальция). Степень диссоциации равна: 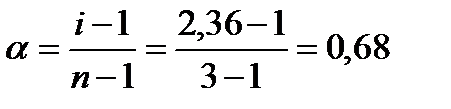 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Задание выполняется на установке, которая представлена на рисунке 1.
В кристаллизаторе 1 приготовьте охлаждающую смесь, состоящую из снега и поваренной соли: 3-5 чайных ложек соли на 5-8 ложек снега.
В стакан 3 налейте 5 -6 мл дистиллированной воды и поместите его в охлаждающую смесь.
Помешивая воду термометром (осторожно, чтобы не разбить термометр), определите температуру замерзания воды. Температурой замерзания считать ту, которую покажет термометр после появления первого кристаллика льда в замораживаемой жидкости.
Аналогично определите температуру замерзания 1 и 2 раствора выданной преподавателем соли. Результаты запишите в таблицу 1.
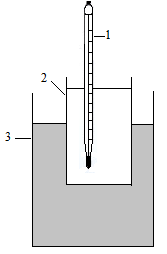
Рис. 1. Схема установки для определения температуры замерзания:
1 - термометр; 2 - стакан с водой или раствором; 3 - охлаждающая смесь.
Таблица 1
| Система | tзам | Δtзам | Изотонический коэффициент i | Степень диссоциации α |
| H2O | - | - | - | |
| С1, моляльный раствор | ||||
| С2, моляльный раствор |
Рассчитайте изотонический коэффициент i. используя формулу
Δtзам = i∙K∙Cm ,
Δtзам = tзам( р-ля) - tзам( р-ра)
K- криоскопическая константа растворителя, К(H2O)=1,86
Cm- моляльность раствора
По полученным данным рассчитайте степень диссоциации раствора KCl в воде по формуле: α = 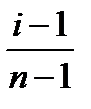
n – число ионов, на которые распадается данная молекула.
Постройте график зависимости температуры замерзания раствора от концентрации растворенной соли.
Сделайте выводы:
1. Сравните температуру замерзания растворителя и растворов, сравните температуру замерзания двух растворов разной концентрации;
2. Сравните степени диссоциации двух растворов разной концентрации.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Вычислить понижение температуры замерзания раствора, если в 550 г бензола растворили 60 г гексана (C6H14), криоскопическая постоянная бензола - Ккр =5,07 К·кг/моль.
2. Вычислить повышение температуры кипения раствора, если в 320 г воды растворить 15 г этанола (C2H5OН), эбулиоскопическая постоянная воды –Кэб= 0,52 К·кг/моль.
3. Вычислить молярную массу этанола, если при растворении в 550 г воды 65 г этанола понижение температуры замерзания раствора составило 4,78ºC, криоскопическая постоянная воды - Ккр=1,86 К·кг/моль.
4. Вычислить осмотическое давление раствора при температуре 26ºC, если в 1 литре раствора содержится 140 г глюкозы.
5. При растворении в 850 г воды 25 г сульфата марганца экспериментальное значение повышения температуры кипения раствора составило 0,18ºC, эбулиоскопическая постоянная воды – Кэб =0,52 К·кг/моль. Вычислить степень диссоциации сульфата марганца.
Лабораторная работа № 3
