Реакции соединения разложения обменя замещения
Соединение - из двух веществ образуется одно новое:
CaO + H2O = Ca(OH)2
Разложение - из одного вещества образуется два или несколько новых:
HNO3 -> NO2 + O2 + H2O
Обмен - два сложных вещества обмениваются составными частями (как правило, ионами) :
Na2SO4 + BaCl2 = 2NaCl + BaSO4
Замещение - реакция между простым и сложным веществом, в результате которой образуется новое простое и новое сложное:
Zn + H2SO4 = H2 + ZnSO4
Каталитические реакции
Каталитические реакции
(циклические) — К. реакциями называются многочисленные химические превращения, вызываемые в различных химических системах веществами, которые, не подвергаясь сами каким-либо постоянным изменениям, одним своим присутствием обусловливают перераспределение атомов в системах, с которыми они приведены в соприкосновение.
Обратимые и необратимые реакции
Реакцию называют обратимой, если её направление зависит от концентраций веществ — участников реакции.
Реакцию называют необратимой, если она может происходить только в одном направлении и завершается полным превращением исходных веществ в продукты
Гомогенные и гетерогенные реакции
Гомогенные реакции протекают в пределах одной фазы, например, в смеси газов или в растворе.
Гетерогенные реакции протекают на границе раздела фаз, например, твердой и жидкой, твердой и газообразной
Экзотермические и эндотермические реакции
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Тепловой эффект химических реакций
ТЕПЛОВОЙ ЭФФЕКТРЕАКЦИИ, теплота, выделенная или поглощенная термодинамич. системой при протекании в ней хим. р-ции. Определяется при условии, что система не совершает никакой работы (кроме возможной работы расширения), а т-ры реагентов и продуктов равны.
Термохимические уравнения
Теплота, высвобождаемая или поглощаемая конкретной химической реакцией, пропорциональна степени превращения реагентов, определяемой по количеству любого из расходуемых либо образующихся продуктов. Изменение внутренней энергии или энтальпии реагирующей системы определяют по химическому уравнению реакции. Например, сгорание смеси газообразных метана и кислорода описывается термохимическим уравнением.
| Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом DH° обозначается изменение энтальпии в химическом превращении при стандартных давлении 1 атм и температуре 298 K (25° С) (знак градуса в верхнем индексе H указывает, что данная величина относится к веществам в стандартных состояниях (при p = 1 атм и T = 298 K)). Химическая формула каждого вещества в таком уравнении обозначает вполне определенное количество вещества, а именно его молекулярную массу, выраженную в граммах. Молекулярная масса получается сложением атомных масс всех элементов, входящих в формулу, с коэффициентами, равными числу атомов данного элемента в молекуле. Молекулярная масса метана равна 16,042, и, согласно предыдущему уравнению, при сгорании 16,042 г (1 моля) метана получаются продукты, энтальпия которых на 212,798 ккал меньше энтальпии реагентов. В соответствии с уравнением (5) такое количество теплоты высвобождается, когда 1 моль метана сгорает в кислороде при постоянном давлении 1 атм. Соответствующее уменьшение внутренней энергии системы в ходе реакции составляет 211,615 ккал. Разница между DH° и DU° равна -1,183 ккал и представляет работу p (V2 - V1), совершаемую, когда 3 моля газообразных реагентов сжимаются при давлении 1 атм до 1 моля газообразного диоксида углерода и 2 молей жидкой воды. Степень окисления вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Окислитель и восстановитель, окисление и восстановление Окисление При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + e− ↔ сопряжённый восстановитель. Восстановление Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: восстановитель - e− ↔ сопряжённый окислитель. Метод электронного баланса Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР). Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР. Для правильного уравнивания следует придерживаться определённой последовательности действий: Найти окислитель и восстановитель. Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу. Уравнять число отданных и принятых электронов в полуреакциях. Просуммировать порознь левые и правые части полуреакций. Расставить коэффициенты в уравнении окислительно восстановительной реакции. Понятие о скорости хим. Реакций Скорость химической реакции - это изменение концентрации реагирующих веществ в единицу времени. Зависимость скорости хим.реакций от различных факторов Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, давления, поверхности соприкосновения веществ и ее характера, присутствия катализаторов. Увеличение концентрации веществ, вступающих в химическое взаимодействие, приводит к увеличению скорости химической реакции. Это происходит потому, что все химические реакции проходят между некоторым количеством реагирующих частицами (атомами, молекулами, ионами). Чем больше этих частичек в объеме реакционного пространства, тем чаще они соударяются и происходит химическое взаимодействие. Химическая реакция может протекать через один или несколько элементарных актов ( соударений). На основании уравнения реакции можно записать выражение зависимости скорости реакции от концентрации реагирующих веществ. Если в элементарном акте участвует лишь одна молекула (при реакции разложения), зависимость будет иметь такой вид: n = k*[A] Обратимые и необратимые реакции Реакцию называют обратимой, если её направление зависит от концентраций веществ — участников реакции. Реакцию называют необратимой, если она может происходить только в одном направлении и завершается полным превращением исходных веществ в продукты; пример — разложение взрывчатых веществ Химическое равновесие и способы его смещения Состояние химического обратимого процесса называется химическим равновесием, если при этом скорость прямой реакции равна скорости обратной реакции. |
9 билет
Нужно обязательно знать разницу между чистыми веществами и смесями. Также есть два понятия чистоты веществ – бытовое и лабораторное. В первом случае чистота относительна, во втором имеется ввиду вещетво без примесей иных веществ. В природе абсолютно чистых веществ нет, их можно получить лишь искусственно.
Смеси веществ состоят из двух и более компонентов. Смеси делят, в свою очередь, на неоднородные и однородные. Неоднородные смеси отличаются тем, что можно увидеть отдельные компоненты. К таким смесям относятся: чернила, паста, камни, бетон, молоко и многие другие.
Однородные смеси характеризуются тем, что их компоненты визуально неотделимы друг от друга. Это минеральные воды, морская вода, воздух, всевозможные растворы и т.д.
Смеси часто разделяют для получения отдельных компонентов. Методы разделения многочисленны, их для удобства разделяют по видам разделяемых смесей.
Неоднородные смеси разделяют отстаиванием и фильтрованием. Это самые легкодоступные методы. Отстаивание основано на разных плотностях компонентов и довольно длительно. Фильтрование основано на разных размерах компонентов и применяет фильтры для их разделения.
Однородные смеси чаще разделяют выпариванием – когда важен компонент, обладающий более высокой температурой кипения, и дистилляцией, когда нужно собрать испаряющийся сразу компонент. Дистилляцией часто пользуются для получения очищенной воды в лабораториях.
Смесь — физико-химическая система, в состав которой входят два или несколько химических соединений (компонент)[1].
В смеси исходные вещества включены неизменными. При этом нередко исходные вещества становятся неузнаваемыми, потому что смесь обнаруживает другие физические свойства по сравнению с каждым изолированным исходным веществом. При смешивании не возникает, тем не менее, никакое новое вещество.
Специфические качества смеси, например, плотность, температура кипения или цвет, зависят от соотношения компонентов смеси (массовое отношение). Смесь двух металлов, полученная путём смешивания их расплавов, называется сплавом. В другой связи говорят о конгломерате. Коллоидные растворы находятся посередине между гомогенными и гетерогенными смесями. В этих жидкостях примешаны твердые частички, каждая из которых состоит из небольшого числа молекул. Поэтому такая смесь ведёт себя как раствор.
Если хотят разделить смесь на чистые вещества, то используют некоторые физические качества. Из этого получается выбор соответствующего разделительного метода.
Различные виды смесей можно классифицировать в 2 группы:
· Гетерогенные смеси полностью не смешаны, так как чистые вещества существуют в ясно отграниченных фазах, то есть это многофазные материалы.
· Гомогенные смеси — это на молекулярном уровне смешанные чистые вещества, то есть однофазные материалы.
Гомогенные смеси делятся по агрегатному состоянию на три группы:
· газовые смеси;
· растворы;
· твёрдые растворы.
Массовая доля – отношение массы растворенного вещества к общей массе раствора.
Объемная доля – отношение объема данного вещества к общему объему смеси.
Массовая доля.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества.
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества.
Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2).

вы вникнете в понятие массовой доли и научитесь ее вычислять.
Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия».
Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3).
Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.:
m(раствора) = m(растворителя) + m(растворенного вещества).
Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач, представленных на рисунке 4 и 5.
Объемная доля.
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой фи (рисунок 6):
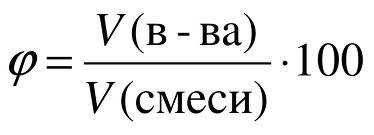
Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рисунок 7).
1. Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество.
2. Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах.
3. Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ. Объемная доля газообразного вещества в газовой смеси обозначается греческой буквой фи.
Вода как растворитель
Самым распространенным растворителем на нашей планете является вода. Тело среднего человека мас–сой 70 кг содержит примерно 40 кг воды. При этом около 25 кг воды приходится на жидкость внутри клеток, а 15 кг составляет внеклеточная жидкость, в которую входят плазма крови, межклеточная жидкость, спинно-моз-говая жидкость, внутриглазная жидкость и жидкое содержимое желудочно-кишечного тракта. У животных и растительных организмов вода составляет обычно бо–лее 50%, а в ряде случаев содержание воды достигает 90—95%.
Вследствие своих аномальных свойств вода – уни–кальный растворитель, прекрасно приспособленный для жизнедеятельности.
Прежде всего вода хорошо растворяет ионные и мно–гие полярные соединения. Такое свойство воды связа–но в значительной мере с ее высокой диэлектрической проницаемостью (78,5).
Другой многочисленный класс веществ, хорошо раст–воримых в воде, включает такие полярные органиче–ские соединения, как сахара, альдегиды, кетоны, спир–ты. Их растворимость в воде объясняется склонностью молекул воды к образованию полярных связей с поляр–ными функциональными группами этих веществ, на–пример с гидроксильными группами спиртов и сахаров или с атомом кислорода карбонильной группы альдеги–дов и кетонов. Ниже приведены примеры водородных связей, важных для растворимости веществ в биологи–ческих системах. Вследствие высокой полярности во–да вызывает гидролиз веществ.
Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Необходимо отметить, что вода является конечным продуктом биологического окисления веществ, в частно–сти глюкозы. Образование воды в результате этих про–цессов сопровождается выделением большого коли–чества энергии – приблизительно 29 кДж/моль.
Важны и другие аномальные свойства воды: высо–кое поверхностное натяжение, низкая вязкость, высо–кие температуры плавления и кипения и более высокая плотность в жидком состоянии, чем в твердом.
Для воды характерно наличие ассоциатов – групп молекул, соединенных водородными связями.
В зависимости от сродства к воде функциональные группы растворяемых частиц подразделяются на гид–рофильные (притягивающие воду), легко сольватируе-мые водой, гидрофобные (отталкивающие воду) и ди-фильные.
К гидрофильным группам относятся полярные функ–циональные группы: гидроксильная —ОН, амино —NH2 , тиольная —SH, карбоксильная —СООН. К гидрофоб–ным – неполярные группы, например углеводородные радикалы: СНз—(СН2)п —, С6Н5 —. К дифильным отно–сят вещества (аминокислоты, белки), молекулы кото–рых содержат как гидрофильные группы (—ОН, —NH2 , —SH, —СООН), так и гидрофобные группы: (СН3 – (СН2)п ,—С6Н5—).
При растворении дифильных веществ происходит изменение структуры воды как результат взаимодей–ствия с гидрофобными группами. Степень упорядо–чения молекул воды, близко расположенных к гидро–фобным группам, увеличивается, и контакт молекул воды с гидрофобными группами сводится к миниму–му. Гидрофобные группы, ассоциируясь, выталки–вают молекулы воды из области своего расположения.
Растворы
Растворами называются термодинамически устойчивые гомогенные системы, состоящие из двух и более веществ, а также продуктов их взаимодействия между собой.
Вещества, образующие раствор, называются иначе его компонентами. Их состав и концентрация в растворе могут изменяться в пределах ограниченных взаимной растворимостью.
Характерной особенностью растворов является то, что составляющие их компоненты присутствуют в них в виде отдельных молекул или ионов, которые равномерно распределяются по всему объему системы. В связи с этим в растворах отсутствует поверхность раздела между веществами и не протекают поверхностные явления, приводящие к значительному увеличению внутренней энергии. Такие растворы называются иначе истинными. Они являются термодинамически устойчивыми, образуются самопроизвольно и могут существовать неограниченно долгое время, если не изменять их количественный состав и условия хранения.
Истинные растворы в зависимости от своего агрегатного состояния подразделяются на газообразные, твердые и жидкие.
Газообразные растворы называются иначе газовыми смесями. Примером такой смеси может служить земная атмосфера, состоящая, главным образом, из азота и кислорода, а также некоторых других веществ, присутствующих в значительно меньших количествах (углекислого газа, водяных паров, благородных газов и т.д.).
Твердыми растворами являются многие сплавы металлов, некоторые неорганические минералы. Образуются твердые растворы при кристаллизации расплавов.
Наибольшее распространение в природе и в хозяйственной деятельности человека получили жидкие растворы. Они, в свою очередь, подразделяются на растворы газов в жидкостях, жидкостей в жидкостях и растворы твердых веществ в жидкостях.
Различают также растворы низкомолекулярных соединений (НМС) и растворы высокомолекулярных соединений (ВМС). Последние по многим свойствам значительно отличаются от растворов НМС и поэтому будут рассмотрены отдельно.
При характеристике составных частей жидких растворов используют понятия растворитель и растворенное вещество. Однако, провести между ними четкую разграничительную линию удается не всегда. Легче всего это сделать, если образующие раствор вещества, в индивидуальном виде находятся в разных агрегатных состояниях. В этом случае растворителем всегда считается то вещество, которое при тех же условиях, что и получившийся раствор, является жидкостью. Твердые и газообразные вещества, входящие в состав такого раствора, называются растворенными веществами.
При образовании раствора из двух смешивающихся жидкостей растворителем чаще всего называют то вещество, которое присутствует в растворе в бульших количествах, или же по взаимной договоренности какое-то конкретное вещество (например, Н2О), независимо от его содержания в системе.
К твердым растворам и газовым смесям понятия растворитель и растворенное вещество не применяют.
Жидкие растворы, в которых в качестве растворителя выступает Н2О, называются водными. Если растворителем является какая-то другая жидкость - неводными.
Для медицины наибольшее значение имеют водные растворы, т.к. Н2О является универсальным растворителем для веществ самой различной природы и составляет основную часть внутренней среды человеческого организма. В зависимости от возраста человека на долю воды в его теле может приходиться от 80 до 50% по массе. При этом важнейшие биологические жидкости (кровь, лимфа, моча, слюна, пот и т.д.) содержат в своем составе различные растворенные вещества: неорганические соли, белки, углеводы, аминокислоты и другие гетеро- и полифункциональные органические соединения. В водной среде в живых организмах протекают многочисленные биохимические реакции. Усваивание пищи связано с переходом питательных веществ в растворенное состояние. Это облегчает их дальнейшую транспортировку биологическими жидкостями к органам и тканям. Выведение из организма метаболитов также осуществляется путем перевода их в растворенное состояние.
