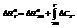Первое начало термодинамики. Закон Гесса. Термохимические расчеты.
Существует множество формулировок первого закона:
В изолированной системе общий запас энергии сохраняется постоянным.
Поскольку работа является одной из форм перехода энергии, то, следовательно, невозможно создание вечного двигателя первого рода (машины, совершающей работу без затраты энергии).
Математическая формулировка: 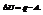
При протекании изобарического процесса:
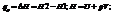
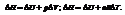
При протекании изохорического процесса:
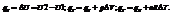
При протекании изотермического процесса:
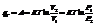
При протекании кругового процесса:
___________________
Термохимия – область физической химии, занимающаяся изучением энергетических эффектов реакций.
Если в уравнении указан ее энергетический эффект – это термохимическое уравнение.
V=const, 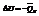
p=const, 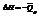
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.
Этот закон – прямое следствие первого закона термодинамики.
С помощью закона Гесса можно вычислять теплоты различных реакций, не проводя самих реакций.
Например: 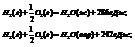
Вывод: теплота испарения одного моля воды равна 44 Дж.
19. Стандартная энтальпия образования. Следствия из закона образования.
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.
Следствия из закона Гесса:
1. тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции.
Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов.
Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ.ю отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении.
2. тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции.
В настоящее время известны теплоты образования свыше 6000 веществ.
Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм.
20. Зависимость теплового эффекта реакции от температуры (закон Кирхгоффа).
Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса (закон Кирхгоффа).
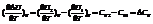
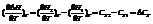
Чтобы подсчитать тепловой эффект процесса при некоторой температуре Т2, нужно знать тепловой эффект процесса при Т1, а также характер изменения теплоемкости системы в интервале температур Т1-Т2.
Обычно в роли Т1 выступает стандартная температура 298К.