I начало термодинамики. Энтальпия. Закон Гесса
Задания для самостоятельной работы
2.19; 2.45; 2.57; 2.61
Дата _______
Лабораторная работа 3.1
Определение стандартной энтальпии реакции нейтрализации.
Цель работы:Научиться калориметрически определять энтальпии реакции нейтрализации.
Приборы, оборудование и реактивы:Макет калориметра, термометр с ценой деления 0,1о(10), мерные цилиндры, растворы кислоты и основания.
Сущность работы:Теплота реакции нейтрализации определяется калориметрически по измеренному изменению температуры и рассчитанной теплоемкости системы.
Лабораторный калориметр
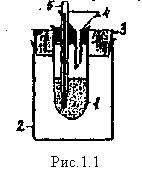
1 – стакан, находящийся в большом термоизоляционном стакане 2, снабженном крышкой 3. С внутренним пространством калориметрического стакана контактируют воронка ; и химический термометр 5.
Энтальпия реакции нейтрализации, протекающей между сильными одноосновными кислотами и сильными однокислотными основаниями практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция:
Н+(aq) + ОН–(aq) = Н2О(ж) ; DН°r = -57,3 кДж/моль.
В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянства не наблюдается, так как часть теплоты расходуется на ионизацию слабой кислоты и слабого основания.
Выполнение эксперимента:
1. Измеряют температуру исходных растворов кислоты и щелочи.
2. Измеряют температуру раствора после проведения реакции.
Экспериментальные данные.
| № опыта | Температура раствора, о С | ||
| кислоты (исх) | щелочи (исх) | после нейтрализации | |
| Среднее значение |
Концентрации растворов кислоты ________моль/л, щелочи________ моль/л,
Объемы растворов реагирующих веществ мл_____
Плотности растворов_______________г/мл_
Масса калориметрического стакана г
Справочные величины
Суд (воды) = 4,184 Дж/г×К Суд (стекла) = 0,753 Дж/г × К
Обработка результатов эксперимента
Рассчитывают теплоемкость системы: С = С1 +С2
Теплоемкость раствора С1 рассчитывают по формуле:
С1 = [V(р-ра к-ты) × r (р-ра к-ты) + V(р-ра осн.) × r (р-ра осн.) ] × Суд (воды)
где V – объемы смешиваемых растворов, мл; r - плотность растворов, г/мл;
Суд (р-ра) – удельная теплоемкость раствора,
Теплоемкость стакана C2 рассчитывают по формуле:
C2 = m × Суд (стекла), где m – масса стакана, г; Суд (стекла) – удельная теплоемкость стекла,
Стандартную энтальпию реакции нейтрализации рассчитывают по формуле:
С × DТ
DН°r = - -------
n
где DТ – разница между средним арифметическим значением температур после реакции и средним арифметическим значением температур до реакции;
n - количество исходного вещества , взятого в недостатке.
Экспериментально определенную величину сравнивают со справочным значением, находят абсолютную и относительную ошибку определения:
Абсолютная ошибка: DН°теор – DН°эксп.
Относительная ошибка: ½DН°теор – DН°эксп½
-------------------------
½DН°теор. ½
Расчеты
* В выводах указывают полученный результат, метод исследования, относительную ошибку.
Вывод:
Дата _________ Занятие _______
Химическая термодинамика. II начало термодинамики.
Энтропия. Химическое равновесие.
