Строение многоэлектронных атомов. Принцип наименьшей энергии. Принцип Паули
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто.
Во многоэлектронных атомах энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни).
Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули (принципПаули):
В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином).
Используя понятия квантовые числа можно сказать, что:
Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел - главногоn,орбитальногоl, магнитного ml, и спинового ms.
Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу:
В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии).
Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию.
4. Правило Клечковского. Правило Хунда.
Правило Клечковского
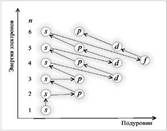
Правило Клечковского — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах. Правило Клечковского гласит: Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел . При одинаковой сумме раньше заполняется орбиталь с меньшим значением .
Энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто:
1s<2s=2p<3s=3p=3d<4s=4p=4d=4f<5s..
К: 1s22s22p63s23p64s1
. 
Правило Хунда
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным.
Сначала появляется один электрон на 2px-орбитали, затем один электрон на 2py-орбитали, после этого один электрон на 2pz-орбитали, затем появляются парные электроны на 2px-, 2py- и 2pz-орбиталях
5.Современная формулировка периодического закона Д.И.Менделеева. Структура периодической системы: периоды, группы, подгруппы.
Современная формулировка гласит: свойства химических элементов находятся в периодической зависимости от заряда ядра этих элементов. (старая гласила: свойства химических элементов находятся в периодической зависимости от атомных масс этих элементов)
Периодическая система – это графическое выражение периодического закона.
Каждый элемент занимает определённое место (клетку) в периодической системе и имеет свой порядковый (атомный) номер.
Горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно, Менделеев назвал периодами
(начинаются щелочным металлом (Li, Na, K, Rb, Cs, Fr) и заканчиваются благородным газом (He, Ne, Ar, Kr, Xe, Rn)). Исключения: первый период, который начинается водородом и седьмой период, который является незавершённым. Периоды разделяются на малые
и большие
. Малые периоды состоят из одного
горизонтального ряда. Первый, второй и третий периоды являются малыми, в них находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды).
Большие периоды состоят из двух горизонтальных рядов. Четвёртый, пятый и шестой периоды являются большими, в них находятся 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Верхние ряды больших периодов называются чётными, нижние ряды – нечётными.
В шестом периоде лантаноиды и в седьмом периоде актиноиды располагаются в нижней части периодической системы.В каждом периоде слева направо металлические свойства элементов ослабевают, а неметаллические свойства усиливаются. В чётных рядах больших периодов находятся только металлы. В результате в таблице имеется 7 периодов, 10 рядов и 8 вертикальных столбцов, названных группами–это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях. Эта валентность равна номеру группы.
Исключения:
| Номер группы | Элемент | Высшая валентность |
| I | Cu Ag Au | II III III |
| VI | O | II |
| VII | H F | I I |
В VIII группе только Ru и Os имеют высшую валентность VIII.
Группы - вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Каждая группа состоит из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов. Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого.
В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами.
6. Энергетические эффекты химических реакций. Внутреняя энергия системы и энтальпия.
Происходящие в ходе хим реакций изменения состава и структуры вещ-в сопровождается выделением или поглощением энергии. Обычно в виде теплоты. Выделение теплоты при взамодразличных вещ-в заставляет признать, что эти вещ-ва ее до реакции с крытой форме обладали опред энергией. Такая форма энергии, скрытая в вещ-ах и освобожд-ся при хим и при некотфизич процессах называется внутр энергией. Она включает в себя энергию движения и взаимод молекул, атомов, ядер, электронов, внутриядерную и др виды энергии, кроме кинет и потенц. Энтальпия – внутр энергия системы, характеризует энергет состояние вещ-ва. Тепловым эффектом хим реакции называется кол-во теплоты, выделенное или поглощённое в рез-те химвзаимод.Тепл эффект реакции, протекающей при постоянном давлении, отражает изменение энтальпии системы DН. Реакции, протек с выдел теплоты, называются экзотерм,энергосод-ие системы сниж-ся и измение энтропии отрицательно; с поглощ –эндотерм, энергосодержувелич, полож. Ура-я реакций, в кот указываются числовые значения тепловых эффектов и агригат состояния, называются термохимическими. Для возможности сравнения тепловых эффектов их относят к стандартным условиям t=298k, p=1атм.
7. Тепловой эффект хим- й рек-и.Закон Гесса и следствия из него.
А) Изм-е энергии сисемы при протек-и в ней хим рек-и наз тепловым эффектом химреак. Если иходные вещ-ва и продукты реакции нах-ся в стандартном сост, то тепловой эффект реакции наз стандартной энтальпией реакции.Реакции , протекающ с выделен теплоты, т. Е. с понижением энтальпией (∆Н˂0) назэкзотермическими.Реакции , протекающ с поглощением теплоты, т. Е. с повышением энтальпиеи (∆Н˃0) назэндотермическими.Уравнение процессов, в которых указаны агрегатные состояния веществ и тепловой эффект, называется термохимическими уравнениями. Тепловой эффект реакции образования одного моля вещества из простых веществ называется стандартной энтальпией вещества.
Б) Термохимические расчеты основаны по закону Гесса. Тепловой эффект реакции не зависит от числа промежуточных стадий, а определяет лишь начальным и конечным состояниями системы.
А+В=АВ
А+С=АС
АС+В=АВ+С
∆Н=∆Н1+∆Н2
Тепловой эффект реакции(энтольпия) рассчитывается согласно следствию из закона Гессе.
∆Н=∑V(∆Н298прод.реак)- ∑V(∆Н298исход.вещ) V-коэф в уравн
Следствия из закона Гесса:
a) Если в результате последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций будет равна нулю.
b) Тепловой эффект реакций (ΔНх.р.) равен сумме теплот образования (или ΔНобр.) конечных веществ (ΔНконеч. в-в) за вычетом суммы теплот образования исходных веществ (ΔНисх. в-в):
ΔНх.р. = Σ ΔНпрод. р-ции – Σ ΔНисх. в-в.
8.Энтропия. Стандартные энтропии.
Энтропия – (S) - частица(молекулы, атомы, ионы) стремящаяся к хаотическому движению а системы к переходу от более упорядоченного сост к менее упорядоченн. Мерой не упорядочен состояния служит термодинамическая функция – энтропия.
S[ Дж/моль] чем больше беспорядок тем больше S.
S зависит от температуры, от плотности молекул, от кол-ва атомов в молекулах, от агрегатного состояния.
Изменение энтропии (Δ S)
S298 – cтандартное значение энтропии.
9. Энергия Гиббса и направленность химических процессов.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
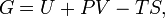
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
