Строение электронных оболочек атомов. Принцип Паули. Принцип наименьшей энергии. Электронные формулы.
Электронная оболочка атома — область пространства наиболее вероятного нахождения электронов, имеющих одинаковое значение главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не может превышать определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Оболочки[править | править код]
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
Количество электронов в каждой оболочке[править | править код]
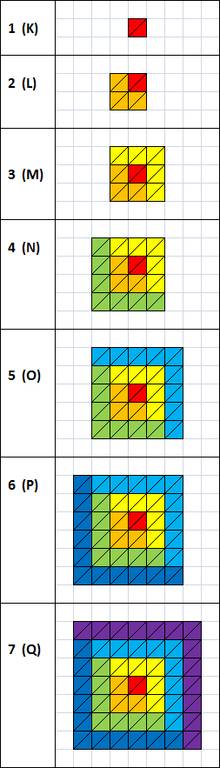
Уровни и подуровни электронной оболочки. 1 прямоугольный треугольник (1/2 клетки) = 1 электрон. Красным цветом обозначен подуровень 0 (s); оранжевым — 1 (p); жёлтым — 2 (d); зелёным — 3 (f); голубым — 4 (g); синим — 5 (h); фиолетовым — 6 (i)
Данное количество вычисляется по формуле:
{\displaystyle \mathrm {2} N^{2}}  , где N — номер оболочки.
, где N — номер оболочки.
| уровень/подуровень | 0 (s) | 1 (p) | 2 (d) | 3 (f) | 4 (g) | 5 (h) | 6 (i) | Итого в оболочке |
| 1 (K) | ||||||||
| 2 (L) | ||||||||
| 3 (M) | ||||||||
| 4 (N) | ||||||||
| 5 (O) | ||||||||
| 6 (P) | ||||||||
| 7 (Q) |
Подуровни оболочек[править | править код]
Каждая оболочка состоит из одного или нескольких подуровней, каждый из которых состоит из атомных орбиталей. К примеру, первая оболочка (K) состоит из одного подуровня «1s». Вторая оболочка (L) состоит из двух подуровней, 2s и 2p. Третья оболочка (M) — из «3s», «3p» и «3d». Четвертая (N) - из «4s», «4p», «4d», «4f». Возможные варианты подуровней оболочек приведены в следующей таблице:
| Обозначение подуровня | l | Макс. кол-во электронов | Содержание в оболочках | Историческое наименование |
| s | В каждой | sharp | ||
| p | Во всех со 2-й | principal | ||
| d | Во всех с 3-й | diffuse | ||
| f | Во всех с 4-й | fundamental | ||
| g | Во всех с 5-й | (Тут и далее алфавитный порядок) | ||
| h | Во всех с 6-й | |||
| i | Во всех с 7-й |
Валентные оболочки[править | править код]
Основная статья: Валентный электрон
Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
Есть и другое объяснение. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т. н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами.
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частицы с полуцелым спином) не могут одновременно находиться в одном и том же квантовом состоянии.
Принцип был сформулирован для электронов Вольфгангом Паули в 1925 г. в процессе работы над квантомеханической интерпретацией аномального эффекта Зееманаи в дальнейшем распространён на все частицы с полуцелым спином. Полное обобщённое доказательство принципа было сделано им в теореме Паули (теореме о связи спина со статистикой) в 1940 г. в рамках квантовой теории поля. Из этой теоремы следовало, что волновая функция системы фермионов является антисимметричнойотносительно их перестановок, поведение систем таких частиц описывается статистикой Ферми — Дирака.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы, в данном квантовом состоянии, может находиться только один фермион, состояние другого должно отличаться хотя бы одним квантовым числом.
В статистической физике принцип Паули иногда формулируется в терминах чисел заполнения: в системе одинаковых частиц, описываемых антисимметричной волновой функцией, числа заполнения могут принимать лишь два значения {\displaystyle N_{p}=0,1} 
Принцип наименьшей энергии
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l= 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd — 4р – 5s и т.д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом
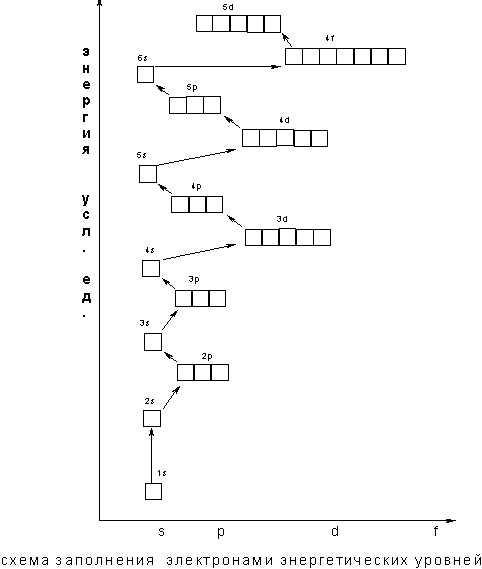
Следовательно, согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен
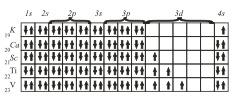 Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd.
Именно поэтому в четвертом периоде сначала заполняется подуровень 4s и лишь после этого подуровень Зd. 
Следующий элемент этого периода — 24Сr. На основании трех основных положений — принципа Паули, правила Гунда и принципа наименьшей энергии — его электронную конфигурацию можно представить так
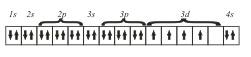
хотя на самом деле у атома 24Cr обнаружены некоторые аномалии и действительная его электронная конфигурация несколько иная (как и еще у одного элемента 29Сr).
Для атомов Mn, Fe, Со и Ni электронные конфигурации будут следующие
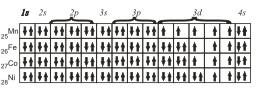
Наконец, последние восемь элементов четвертого периода имеют конфигурации
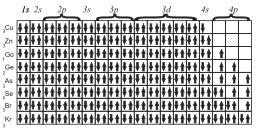
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.
Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p < 8s. При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного (орбитального) квантового числа l , т.е. n + l , имеет меньшее значение.
10вопрос . Периодический закон Д.И.Менделеева.
периодический закон - закон, объясняющий закономерности изменения свойств элементов. Он был открыт в результате огромной исследовательской работы Д.И.Менделеева. Д.И.Менделеев пришел к открытию закона, сопоставляя свойства и относительные атомные массы элементов различных естественных групп. В то время было известно 6 таких групп – щелочные металлы, щелочноземельные металлы, галогены, группа кислорода, группа азота, группа углерода. В своей черновой работе над классификацией элементов Д.И.Менделеев использовал карточки элементов, в которых были выписаны их основные характеристики, эти карточки он располагал в порядке увеличения атомных весов элементов. Благодаря глубокому анализу, сравнению и обобщению известных данных в 1869 г. Д.И.Менделеев сформулировал периодический закон: «Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от их атомного веса».
На основе периодического закона Д.И.Менделеев исправил характеристики некоторых известных элементов (например, атомный вес и валентность Ве), а также предсказал новые элементы, которые ещё не были известны в то время (Д.И.Менделеев назвал их экаалюминием, экабором, экасилицием. Позднее эти элементы были открыты и получили название галлий, скандий, германий).
11 вопрос 11. Периодическая система элементов. Её значение в свете учения о строении атома
Периодический закон Менделеева фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств всех известных в то время элементов и величин их атомных весов. Термин "периодический закон" Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку П. з. : "... свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса" ("Периодический закон. [Основные статьи] ", 1958, с. 111). Графическим (табличным) выражением П. з. явилась разработанная Менделеевым периодическая система элементов.
Физический смысл П. з. был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома (см. Атом) . Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе П. з. лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. Наглядная иллюстрация П. з. - кривые периодические изменения некоторых физических величин (ионизационных потенциалов, атомных радиусов, атомных объёмов) в зависимости от Z (см. Атомная физика). Какого-либо общего математического выражения П. з. не существует.
П. з. имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря П. з. многие научные поиски (например, в области изучения строения вещества - в химии, физике, геохимии, космохимии, астрофизике) получили целенаправленный характер. П. з. - яркое проявление действия общих законов диалектики, в частности закона перехода количества в качество.
