Принцип Паули и емкость электронных оболочек. Правило Хунда. Порядок заполнения атомных орбиталей. Правила Клечковского. Строение электронных оболочек атомов химических элементов.
Распределение электронов в многоэлектронном атоме основано на принципе минимума энергии, принципе В.Паули, правиле Ф.Хунда и правиле Клечковского.
Принцип минимума энергии: Электрон в первую очередь располагается в пределах электронной подоболочки с наинизшей энергией. Вначале заполняются орбитали, характеризующиеся наименьшей потенциальной энергией.
Принцип Паули:В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь, характеризующаяся определенными значениями n, ℓ и mℓ, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными. Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом уровне и подуровне, т.е. определить емкость уровней и подуровней. Количество орбиталей на подуровне определяется количеством возможных значений магнитного квантового числа, т.е. 2ℓ + 1 значение. Так как на каждой орбитали (определенное значение квантовых чисел n, ℓ и mℓ) может разместиться два электрона, обладающие разными значениями спина, то максимальное количество электронов, которое можно разместить на данном подуровне равно: 2(2ℓ + 1). Максимальное количество электронов, которое может находиться на данном уровне, характеризующемся главным квантовым числом n, равно 2n2.
Правило Хунда: В наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален. м являеисясостояниеки наиболлеронов, которое может находиться на данном уровне, характеризующимся главным квантовым числом
Так, например, у атома азота на внешнем электронном уровне находится два и три р-электрона. Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа. s-Подуровень содержит единственную орбиталь, на которой находится два электрона с противоположными спинами в соответствии с принципом Паули. В соответствии с правилом Хунда минимум энергии будет обладать конфигурация, в которой на каждой из трех р-орбиталей будет находиться по одному электрону с одинаково направленными спинами, поэтому суммарный спин будет максимальным (±3/2):
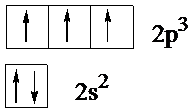
Первое правило Клечковского: Электрон обладает наинизшей энергией на той электронной подоболочке, где сумма главного и орбитального квантового числа минимальна. Е = min при n + ℓ = min. В соответствии с первым правилом Клечковского заполнение подуровней электронами происходит в порядке от подуровней с минимальным значением суммы (n + ℓ) к подуровням большими значениями n + ℓ . Если сумма (n + ℓ) одинакова для рассматриваемых электронных подоболочек, при распределении электронов используется второе правило Клечковского: Электрон обладает наинизшей энергией на подоболочке с наименьшим значением главного квантового числа
Периодический закон и периодическая система элементов. Заполнение электронами
атомных орбиталей и формирование периодов и групп. Главные и побочные подгруппы. Электронные аналоги, изоэлектронные частицы.
При ℓ = 0, т.е. на s-подуровне *, имеется всего одна орбиталь *, которую принято изображать в виде клетки. В атоме Н единственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой: 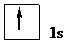
В атоме гелия, порядковый номер которого в периодической системе * (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия: 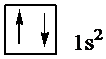
У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
У следующего за гелием элемента лития (Z=3) третий электрон уже не может разместиться на орбитали K-слоя. K-слоем называется первый электронный слой атома: это противоречило бы принципу Паули. Поэтому он занимает s-состояние второго энергетического уровня (L-слой. L-слоем называется второй электронный слой атома, n=2). Его электронная структура записывается формулой 1s22s1. Электронная структура следующих за ним бериллия и бора соответствует формуле 1s22s2 и 1s22s2р1 что соответствует схеме:
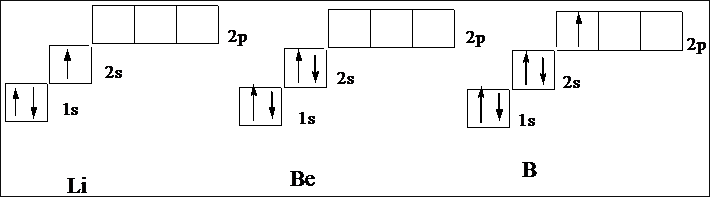
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
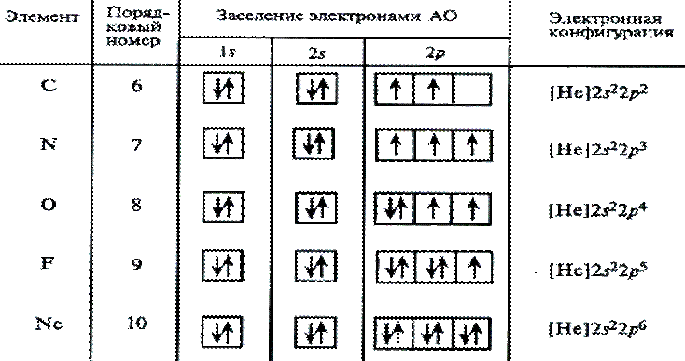
Используется сокращенная форма записи электронной структуры атома. При этом расписывается структура внешнех незаполненных уровней, а вместо электронной структуры внутренних слоев в скобках указывается символ инертного газа, электронная структура которого соответствует оставшейся части электронной формулы. Так для элементов второго периода полностью заполненным является первый электронный уровень (n = 1), соответствующий атому гелия. Электронная формула в сокращенном варианте атомов: лития – [He]2s1, бериллия – щенном варианте атомаом варианте атома лития: Так для элементов второго периода полностью электронная структура кото[He]2s2, бора – [He]2s22p1.
Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома азота (Z=7): Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
O 1s22s22p4;
F 1s22s22p5;
Ne 1s22s22p6
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Такие элементы называются s-элементами. Говоря по-другому, они относятся к семейству s-элементов. (т.е. они относятся к s-семейству элементов). Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Это атомы p-элементов (принадлежат к p-семейству). Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Однако электронное строение атомов определяет свойства элементов и их соединений. В этом состоит сущность периодического закона: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра.
У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и начинает формироваться s-подуровень 4-го слоя. Такой порядок заполнения вытекает из первого. Первое и второе правила Клечковского часто не разделяют, а считают одним совместным правилом Клечковского: при увеличении заряда ядра атомов заполнение энергетических уровней происходит от орбиталей с меньшим значением суммы главного * и орбитального * квантовых чисел (n+ℓ) к орбиталям с большим значением этой суммы. Следовательно, 4s-подуровень (n+ℓ = 4) должен заполняться раньше, чем 3d (n+ℓ = 5). Для атома скандия возникает вопрос: какой из подуровней должен заполняться – 3d или 4p, т.к. сумма n+ℓ для них одинакова и равна 5. В подобных случаях порядок заполнения определяется вторым. Согласно правилу Клечковского при одинаковых значениях суммы (n+ℓ) орбитали заполняются в порядке возрастания главного квантового числа n. Заполнение 3d-подуровня происходит у десяти элементов от Sc до Zn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня (p-элементы от Ga до Kr). Как и атомы предшествующих благородных газов – неона и аргона – атом криптона характеризуется структурой внешнего электронного слоя ns2np6.
Аналогично формируется пятый период.
В шестом периоде после заполнения 6s-подуровня начинается заполнение 4f-подуровня, и следуют атомы f-элементов. В связи с тем, что у них внешним является шестой уровень, а электроны последовательно занимают 4-й уровень, лежащий гораздо ближе к ядру, то химические свойства всех этих f-элементов близки к лантану, поэтому их часто называют лантаноидами (в 7-м периоде f-элементы называются актиноидами). После 4f заполняется 5d и, наконец, 6p-подуровень, заполнением которого заканчивается построение шестого периода. Седьмой период не завершен, т.к. элементы с большим зарядом ядра оказываются очень неустойчивыми (легко протекают ядерные реакции).
Порядок заполнения подуровней в соответствии с правилами Клечковского можно записать в виде последовательности: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s→ 5f→ 6d → 7p. Однако для некоторых элементов эта последовательность нарушается, т.е. из правил Клечковского имеются исключения. У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, в большинстве соответствующему полностью (Cu, Pd, Ag, Pt, Au) или наполовину (Cr, Mo) заполненному d-подуровню. Например, электронная формула атома меди имеет вид: Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1, т.е. один из двух 4s-электронов “проваливается” на 3d-подуровень. Особо следует отметить палладий, у которого “проваливаются” два электрона: Pd 1s2 2s2 2p6 3s2 3p6 4s2 4p6 4d10 5s0. Второй тип исключений из правила Клечковского состоит в том, что перед заполнением 4f-подуровня один электрон располагается на 5d-подуровне: La 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f0 5s2 5p6 5d1 6s2. У следующего элемента (церия) 5d-подуровень освобождается, и оба электрона располагаются на 4f-подуровне: Ce 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f2 5s2 5p6 5d0 6s2. Аналогично, в 7-м периоде у актиния последний из электронов располагается на 6d-подуровне (а не на 5f, как должно быть по правилам Клечковского).
Структура периодической системы элементов Д.И. Менделеева: Периодическая система состоит из периодов и групп. Порядковый номер элемента в периодической системе равен заряду ядра, или количеству протонов в нем, а также количеству электронов в оболочке нейтрального атома.
Основные частицы, составляющие атом: частицы символ масса заряд, K; протон p 10-27 1,602.10-19; нейтрон n 10-27 0; электрон е 10-31 1,602.10-19
Ядро атома имеет положительный заряд. Заряд ядра определяется числом протонов.
Атом целиком электронейтрален, т.к. заряд ядра компенсируется зарядом электронов.
Масса ядра складывается из массы протонов и нейтронов.
Масса атома принимается равной массе ядра, т.к. массой электронов пренебрегают.
Важнейшим для химических свойств элементов являются заряды ядер, а не атомные массы. Это доказывается химическими свойствами изотопов и изобаров.
Изотопы - химические элементы, имеющие одинаковые заряды ядер, но разные атомные массы: Сl35 17р + 18n и
Cl37 17р + 20n
Химические свойства хлора -35 и хлора -37 одинаковы.
Изобары - химические элементы с различными зарядами ядер, но с одинаковыми атомными массами: 18Ar40; 19К40; 20Са40. Химические свойства Ar, K, Ca различны.
Период – последовательный ряд элементов, атомы которых различаются числом электронов в наружном слое. Каждый период начинается типичным металлом и завершается благородным газом. Номер периода совпадает со значением главного квантового числа внешнего электронного уровня.
Принадлежность элементов к группам и деление их на подгруппы зависит от структуры двух внешних слоев. В соответствии с количеством электронов в этих слоях элементы периодической системы разделены на 8 групп. Номер группы совпадает с числом валентных электронов элемента. Валентными являются в первую очередь ns- и np-электроны (n – номер внешнего электронного слоя), а затем (n–1)d-электроны. Для примера рассмотрим электронные формулы хлора и марганца.
Cl 1s22s22p63s23p5 или [Ne] 3s23p5
Mn 1s22s22p63s23p63d54s2 или [Ar] 3d54s2
Здесь подчеркнуты валентные электроны, количество которых в обоих случаях равно 7. В соответствии с этим Cl и Mn находятся в VII группе периодической системы. В каждой группе главную подгруппу образуют атомы s- и p-элементов, а побочную – атомы d- и f-элементов.
В одну подгруппу включены элементы, атомы которых имеют подобную структуру валентных подуровней, т.е. они имеют одинаковое количество электронов на внешних орбиталях, отличающихся лишь значением главного квантового числа. Такие элементы называются электронными аналогами. Например, структура валентного электронного слоя элементов главной подгруппы седьмой группы (F, Cl, Br, I, At), являющихся электронными аналогами, может быть выражена формулой: ns2np5, а побочной подгруппы (Mn, Tc, Re) – (n-1)d5ns2.
Изоэлектронными называются частицы (атомы, молекулы, ионы), которые содержат одинаковое количество электронов. Например, Cr, HCOOH, Fe2+ (количество электронов в каждой частице равно 24).
Периодичность свойств атомов. Изменение радиусов атомов по периодам и группам.
Энергия ионизации атомов. Изменение энергии ионизации по периодам и группам. Сродство
к электрону. Электроотрицательность элементов, изменение величины ЭО в периодической
системе.
| Атом | Li | Be | B | C | N | O | F |
| r, нм | 0,155 | 0,113 | 0,091 | 0,077 | 0,071 | 0,066 | 0,064 |
Размеры атомов и ионов: Вследствие волновой природы электрона атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Их обычно вычисляют из межатомных расстояний, которые зависят не только от природы атомов, но также и от вида химической связи между ними.
Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атомов. Например, во втором периоде атомные радиусы имеют следующие значения:
Это объясняется увеличением притяжения электронов внешнего слоя к ядру по мере возрастания заряда ядра. В подгруппах сверху вниз атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
| Атом гр. I A | Li | Na | K | Rb | Cs |
| r, нм | 0,155 | 0,189 | 0,236 | 0,248 | 0,268 |
| Атом гр.V A | N | P | As | Sb | Bi |
| r, нм | 0,071 | 0,130 | 0,148 | 0,161 | 0,182 |
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению. Поэтому радиус положительного иона (катиона) всегда меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус соответствующего электронейтрального атома. Радиус иона тем сильнее отличается от радиуса атома, чем больше заряд иона. Например:
| Атом, ион | K0 | K+ | Cl0 | Cl– | Cr0 | Cr2+ | Cr3+ |
| r, нм | 0,236 | 0,133 | 0,099 | 0,181 | 0,127 | 0,083 | 0,064 |
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра:
| катион | Li+ | Na+ | K+ | Rb+ |
| r, нм | 0,068 | 0,098 | 0,133 | 0,149 |
| анион | F– | Cl– | Br– | I– |
| r, нм | 0,133 | 0,181 | 0,196 | 0,220 |
Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.
Энергия ионизации и сродство к электрону. В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации (потенциалом ионизации) I – количество энергии, необходимое для отрыва электрона от невозбужденного атома с образованием катиона: X – e- = X+, измеряется в кДж/моль или в электронвольтах 1 эВ = 1,602.10-19 Дж или 96,485 кДж/моль. (эВ). Отрыв второго электрона происходит труднее, чем первого, т.к. второй электрон отрывается не от нейтрального атома, а от положительного иона: X+ – e - = X2+
Поэтому второй потенциал ионизации I2 больше, чем первый (I2>I1). Очевидно, что удаление каждого следующего электрона будет требовать больших энергетических затрат, чем удаление предыдущего. Для характеристики свойств элементов обычно принимают во внимание энергию отрыва первого электрона.
В группах потенциал ионизации уменьшается с увеличением атомного номера элемента:
| Атом гр. I A | Li | Na | K | Rb | Cs |
| I, эВ | 6,39 | 5,14 | 4,34 | 4,18 | 3,89 |
Это связано с большей удаленностью валентных электронов от ядра и, следовательно, с их более легким отрывом по мере увеличения количества электронных слоев. Величина потенциала ионизации может служить мерой “металличности” элемента: чем меньше потенциал ионизации, тем легче удалить электрон из атома, тем сильнее выражены металлические свойства.
В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают. Возрастание происходит не строго, а с некоторыми отступлениями. Например, во втором периоде от бериллия к бору и от азота к кислороду уменьшается потенциал ионизации:
| атом | Li | Be | B | C | N | O | F | Ne |
| I, эВ | 5,39 | 9,32 | 8,30 | 11,26 | 14,53 | 13,61 | 17,42 | 21,56 |
Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем (Be), либо для атомов, у которых внешний энергетический подуровень заполнен ровно наполовину (N).
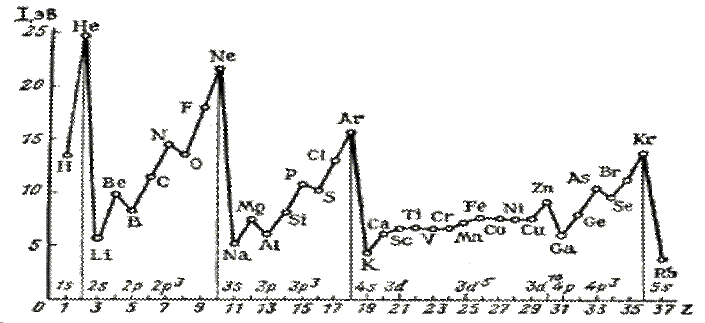
Рис – Потенциалы ионизации атомов элементов 1 – 4 периодов и рубидия. Наблюдается тенденция к возрастанию энергии ионизации атомов в периоде с увеличением заряда ядра (порядкового номера) элементов с некоторыми исключениями, обусловленными устойчивостью конфигураций с полностью или наполовину заполнеными подуровнями (подоболочками): Be–B, Mg-Al, Zn-Ga (полностью заполнен s-подуровень), N-O, P-S, As-Se(наполовину заполнен р-подуровень). Самый высокий потенциал ионизации наблюдается у атомов элементов с полностью заполненной оболочкой He, Ne, Ar, Kr. У Rb самый низкий потенциал ионизации, так как он является щелочным металлом (находится в самом начале периода) и имеет большой радиус атома.
Это свидетельствует о повышенной энергетической устойчивости электронных конфигураций с полностью или ровно наполовину занятыми подуровнями.
Степень притяжения электрона к ядру и, следовательно, потенциал ионизации зависят от ряда факторов, и прежде всего от заряда ядра (заряд ядра равен порядковому номеру элемента в таблице Менделеева), от расстояния между электроном и ядром, от экранирующего влияния других электронов. Так, у всех атомов, кроме элементов первого периода, влияние ядра на электроны внешнего слоя экранировано электронами внутренних слоев.
Поле ядра атома, удерживающее электроны, притягивает также и свободный электрон, если он окажется вблизи атома. Правда, этот электрон испытывает отталкивание со стороны электронов атома. Для многих атомов энергия притяжения дополнительного электрона к ядру превышает энергию его отталкивания от электронных оболочек. Эти атомы могут присоединять электрон, образуя устойчивый однозарядный анион. Энергию, которая выделяется при присоединении электрона к нейтральному атому с образованием отрицательного однозарядного иона в процессе X0 + e - = X– называют сродством атома к электрону (Ес), измеряемым в кДж/моль или эВ/атом. 1 электронвольт = 1,602.10-19 Дж или 96,485 кДж/моль. Сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона, т.е. оно противоположно процессу: X– - e - = X0. При присоединении двух и более электронов к атому отталкивание преобладает над притяжением – сродство атома к двум и более электронам всегда отрицательно. Поэтому одноатомные многозарядные отрицательные ионы (O2–, S2–, N3– и т.п.) в свободном состоянии существовать не могут.
Сродство к электрону известно не для всех атомов. Максимальным сродством к электрону обладают атомы галогенов.
Электроотрицательность – Эта величина характеризует способность атома в молекуле притягивать к себе связующие электроны. Электроотрицательность не следует путать со сродством к электрону: первое понятие относится к атому в составе молекулы, а второе – к изолированному атому. Абсолютная электроотрицательность (кДж/моль или эВ,
1 электронвольт = 1,602.10-19 Дж или 96,485 кДж/моль. ) равна сумме энергии ионизации и сродства к электрону: АЭО=I+A. На практике часто применяется величина относительной электроотрицательности, равная отношению АЭО данного элемента к АЭО лития (535 кДж/моль): ОЭО = АЭО(Элемент)/АЭО(Li)
Электроотрицательность уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительные электроотрицательности (ОЭО) некоторых элементов.
| Элемент | Li | Be | B | C | N | O | F |
| ОЭО | 1,0 | 1,5 | 2,0 | 2,5 | 3,1 | 3,5 | 4,0 |
| Элемент | Na | K | Rb | Cs | Cl | Br | I |
| ОЭО | 0,9 | 0,8 | 0,8 | 0,7 | 3,0 | 2,8 | 2,6 |
Из приведенных в таблице элементов наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий. Водород занимает промежуточное положение, т.е. при взаимодействии с одними элементами (например, с F) он отдает электрон, а при взаимодействии с другими (например, с Rb) – приобретает электрон.
Периодичность изменения химических свойств элементов, простых веществ и химических соединений в периодической системе. Изменение валентности по периодам и группам. Металлический и неметаллический характер элементов. Изменение химической активности металлов и неметаллов по периодам и группам. Изменение кислотно-основных свойств оксидов и гидроксидов.
Окислительно-восстановительные свойства нейтральных атомов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону.
Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
| Ст. окисл. элем. | Na+ | Mg2+ | Al3+ | Si4+ | P5+ | S6+ | Cl7+ |
| оксид | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| гидро | NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
| Тип гидроксида | основные | Амфотерный | Слабо кислотный | средне кислотный | сильно кислотные |
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются, например в третьей группе, основной подгруппе:
| Степень окисления элемента | B3+ | Al3+ | Ga3+ | In3+ | Tl3+ |
| гидроксид | H3BO3 | Al(OH)3 | Ga(OH)3 | In(OH)3 | Tl(OH)3 |
| Тип гидроксида | слабая кислота | амфотерные гидроксиды | более выражены основные свойства |
Аналогичный пример можно привести для кислородсодержащих кислот элементов VI группы:
сила кислот убывает в ряду H2SO4 (серная кислота) < H2SeO4 (селеновая кислота) < H2TeO4 (теллуровая кислота).
Металлический и неметаллический характер элементов:
Металличность - это способность атомов элемента отдавать электроны. Количественной характеристикой металличности является энергия ионизации. Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлический свойства элемента.
Неметалличность – это способность атомов элемента присоединять электроны. Количественной характеристикой неметалличности является сродство к электрону ( сродство к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому, т.е. при привращении атома в отрицательно заряженный ион). Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее неметаллические свойства элемента.
По периоду: металличность уменьшается, неметалличность увеличивается.
По подгруппе: металличность увеличивается, неметалличность уменьшается.
Изменение валентности: в малых периодах закономерно изменяется высшая валентность элементов: во втором периодн от I у Li до V у N; в третьем периоде от I у Na до VII у Cl. В большом четвертом периоде высшая валентность увеличивается от I у K до VII у Mn; у следующих элементов она понижается до II у Zn, а потмо снова увеличивается от III у Ga до VII у Br. Периодическое изменение высшей валентности объясняется периодическим изменением числа валентных электронов в атомах.
Валентные электроны – это электроны, котореы могут участвовать в образовании химических связей. В атомах s- и p-элементов валентными являются, как привало, все электроны внешнего слоя. В атомах d-элементов валентными являются электроны внешнего слоя (2 или 1), а также все или некоторые d-электроны предвнешнего слоя. Число валентных электронов для большинтсва элементов равно номеру группы.
