Основные виды межмолекулярных взаимодействий. Силы Ван-дер-Ваальса. Понятие о водородной связи. Влияние межмолекулярного взаимодействия на физические свойства веществ.
Виды межмолекулярного взаимодействия:
1.ориентационные(диполь дипольная):
Полярная+ полярная
E (ор)=-A/r^6, где А=-2M^4/3r^6*k*T, M- электрический момент диполя
r-расстояние между центрами центральных атомов,T-температура;
Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение
2.Индукционная (природа электростатическая)
Неполярная+полярная
Е(инд)=-B/r^6; где В=-2а(альфа)М/r^6
a(альфа)-поляризуемость, деформация связи под действием внешнего поля
Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только намного слабее, чем две полярные молекулы.
Дисперсионные силы ( лондоновские силы)
(Природа квантово-механическая)
Дисперсионные силы универсальные силы, действуют во всех молекулах, за счет них можно сжижать кислород, водород.
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи
Силы ванн-дер-ваальса :
Существование веществ в жидком и твердом состояние однозначно свидетельствует о том, что между молекулами, а также атомами, существуют силы притяжения -силы Ван-дер-Ваальса. Благодаря им газы можно перевести в жидкое и твердое состояние.
Водородная связь-это особый вид связи, который обусловлен уникальностью водорода.
Водородная связь имеет смысл в том случае, когда водород связан электроотрицательным элементом.
По энергии водородная связь имеет порядок 10-40.
Водородная связь:
-межмолекулярная
-внутримолекулярная
11. Понятия о системах (открытые, закрытые, изолированные); процессах (самопроизвольные, изобарно-изотермические, изохорно-изртермические); типах химических реакций (гомогенные и гетерогенные, обратимые и необратимые, экзо- и эндотермические). Энтальпийные диаграммы(в тетради). Первый закон (“начало”) термодинамики. Внутренняя энергия и энтальпия вещества. Стандартная энтальпия образования простого и сложного вещества. Закон Гесса (основной закон термохимии) и следствия из него. Расчет тепловых эффектов химических реакций на основе 1-го следствия из закона Гесса.
Понятие об энергии Гиббса, ее физический смысл. Основное уравнение химической термодинамики для реальных процессов. Условие (критерий) самопроизвольного протекания реакции. Влияние энтальпийного и энтропийного фактора на возможность протекания реакции. Условие химического равновесия с точки зрения термодинамики. Расчет температуры, соответствующей состоянию термодинамического равновесия.
Система-это тело или группа тел выделенная из окружающей среды и характеризующаяся определенными свойствами.
Виды:
1. Изолированные(m=не const E=const)
2. Открытые(m,E=const)
3. Закрытые(m=const, E= не const)
Процессы- переход системы из одного состояния в другое.
Виды:
1. Р,Т=const-изобарный р=0
2. V,T=const-изохорный v=0
3. Самопроизвольный процесс- процессы, которые в одном направление идут без воздействия внешних сил, а при возврате только при совершение работы.
Типы химических реакций:
Гомогенные- системы состоящие из одной фазы.
Гетерогенные- системы состоящие из нескольких фаз, между которыми имеются поверхности и разделы.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном)
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Экзотермические реакции всегда происходят произвольно(95%), но и эндотермические реакции иногда могут проходить самопроизвольно.
H2O(лед)---H2O(жид)
Экзогенные реакции: Н<0
Эндогенные реакции: Н>0
Стандартные теплоты образования простых веществ, в наиболее устойчивых агрегатных состояниях и аллотропических модификациях принято брать равным 0.
Теплоты образования сложных веществ- это та теплота, которая выделяется или поглощается при образование одного моля вещества из простых веществ, устойчивых в стандартных условиях.
Внутренняя энергия- полный запас энергии всех частиц, из которой состоит система, за исключением потенциальной и кинетической энергии системы, как целого.
Энтальпия-теплосодержание системы.
Закон гесса(закон сохранения и превращения энергии):
Энергия не возникает и не исчезает из ничего, она только видоизменяется переходя из одной формы в другую в строго эквивалентных соотношениях.
Для изолированной системы U=0;
1.Q=U+A; Q=U+p*V; V,T=const; V=0;Q=U;
2.p,T=const; Q=U+p*V=U2-U1+p(V2-V1)=(U2+p*V2)-(U1+p*V1)=H2-H1=H
Q=H
Следствия из закона:
1. Тепловой эффект химической реакции-сумма кислот образования конечных веществ за вычетом суммы теплот образования исходных веществ с учетом стехиометрических знаков.
/
1. Тепловой эффект химической реакции- это та теплота, которая выделяется или поглощается в результате этой реакции.
2. Энтропия- количественная мера беспорядка, хаотичности неупорядоченной системы.
Энтропия в отличие от других показателей имеет абсолютный показатель, потому что только для идеального кристалла при абсолютном 0 температура энтропии равна 0.
В изолированных процессах самопроизвольно протекают процессы в сторону увеличения энтропии.
На любую реакцию системы действуют 2 силы
1. Упорядочивает систему(понижает энергию)- энтальпийный фактор;
2. Стремится разупорядочить систему, внести в нее беспорядок- энтропийный фактор
Обе силы действуют в противоположных направлениях.
Энергия гиббса:
G=H-T*S;
Направление процесса зависит от энтальпийного и энтропийного фактора.
1.H<0 S>0 => G<0
Глубина протекания реакции определяется величиной G, чем G больше тем глубина протекания меньше.
2.G>0, следовательно реакция неосуществима в прямом направление и она не пойдет произвольно.
3.G=0 следовательно H=T*S; T(начала)=H/S
Понятие о скорости гомогенной и гетерогенной реакций. Факторы, влияющие на скорость химической реакции. Зависимость скорости реакции от концентраций реагирующих веществ - закон действующих масс (основной закон химической кинетики), кинетическое уравнение реакции. Константа скорости реакции, ее физический смысл. Зависимость скорости реакции от температуры, правило Вант-Гоффа. Понятие об энергии активации реакции. Распределение Максвелла-Больцмана. Уравнение Аррениуса. Катализаторы и ингибиторы, сущность их действия.
Понятие и физическом (фазовое) и химическом равновесиях. Условие равновесия с точки зрения химической кинетики. Константа равновесия, ее физический смысл. Равновесные концентрации реагентов и продуктов. Смещение равновесий по принципу Ле Шателье, влияние изменения температуры, давления, концентраций исходных и конечных веществ.
Скорость гомогенной реакции в целом определяется как скорость изменения глубины протекания реакции в единицу времени в единице объема:
| r = 1 d ξi V dt |
Где V- объем системы; t – время. Определенная таким образом скорость реакции не зависит от выбора компонентов и будет практически одинаковой для разных веществ, участвующих в реакции.
Скорость гетерогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы.
Величину поверхности твердого тела не всегда легко измерить. Поэтому иногда скорость гетерогенной реакции относят не к единице поверхности, а к единице массы или объема твердой фазы.
Скорость химической реакции пропорциональна произведению реагирующих веществ.
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
1. природа реагирующих веществ,
2. наличие катализатора,
3. температура (правило Вант-Гоффа),
4. давление,
5. площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная.
Для реакции
A+B=C+D этот закон выразится уравнением:
v = kcAcB,
где сA и сB — концентрации веществ А и В, моль/л; k — коэффициент пропорциональности, называемый константой скорости Реакции. Основной закон химической кинетики называют законом действующих масс.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
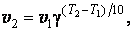
где v2 и v1 - скорости реакции при температурах Т2 и Т1, γ - коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2 – 4.
При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Правило Вант – Гоффа запишется так:
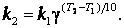
Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
Эти два уравнения можно использовать лишь для ориентировочных расчетов, так как точность их не очень высока.
Катализатор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Ингибиторы- вещества, тормозящие хим. реакции. Ингибирование характерно для каталитич и цепных реакций, которые протекают с участием активных центров или активных частиц. Тормозящее действие обусловлено тем, что ингибитор блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов, не способных продолжать цепь. Ингибиторы вводится в систему в концентрации много меньшей, чем концентрации реагирующих веществ (10-2-10-5 моль%).
шведский ученый Аррениус на основании экспериментов вывел уравнение, которое названо его именем
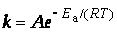 ,
,
где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа для химических реакций лежат в пределах 40 – 400 кДж/ моль.
После логарифмирования уравнение имеет вид
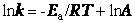
Итак, константа скорости реакции (и скорость) возрастает с увеличением температуры по экспоненциальному закону. В соответствии с уравнением Аррениуса константа скорости реакции уменьшается с ростом энергии активации. Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) при различных температурах.
ФАЗОВОЕ РАВНОВЕСИЕ, сосуществование термодинамически равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства т-ры всех частей системы, равенства давления во всем
объеме системы и равенство хим. потенциалов каждого
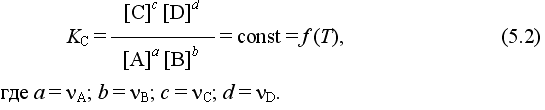 компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f находящихся одновременно в равновесии,связано с числом компонентов , числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние т-ры и давления, n= 2), и числом термодинамич. степеней свободы v ур-нием: v = k + 2 -f .
компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f находящихся одновременно в равновесии,связано с числом компонентов , числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние т-ры и давления, n= 2), и числом термодинамич. степеней свободы v ур-нием: v = k + 2 -f .
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
В соответствии с законом действующих масс состояние равновесной химической системы характеризуется константой равновесия: В выражение константы входят равновесные концентрации веществ, взятые в степенях, равных коэффициентам перед веществом в уравнении реакции.
Константа равновесия отражает глубину протекания процесса. Чем больше величина константы равновесия, тем выше концентрация продуктов реакции в момент равновесия, т.е. тем полнее протекает реакция.
Принцип Ле Шателье говорит о том, что для смещения равновесия вправо нужно, во-первых, повышать давление. Действительно, при повышении давления система будет «сопротивляться» возрастанию концентрации газов – для этого активизируется прямая реакция превращения четырех молекул газа (одной молекулы азота и трех водорода) в две молекулы газообразного аммиака. Во-вторых, необходимо отводить образующееся в реакции теплоту, т.е. понижать температуру. Если температуру повышать, то обратная реакция ускорится в большей степени, поскольку она идет с поглощением теплоты. Однако если охлаждать реактор слишком сильно, то обе реакции замедляются и равновесие устанавливается слишком медленно.
13. Растворы. Классификация растворов (насыщенные, ненасыщенные пересыщенные; концентрированные и разбавленные). Способы выражения концентрации растворов (массовая доля, процентная концентрация, молярность, нормальность и моляльность раствора). Диаграмма состояния воды. Физико-химические (коллигативные) свойства разбавленных растворов неэлектролитов - законы Рауля и Вант-Гоффа. Понятие о веществах – электролитах. Кислоты, соли и основания с точки зрения теории электролитической диссоциации Аррениуса. Сильные и слабые электролиты. Ступенчатая диссоциация кислот и оснований. Количественные характеристики способности веществ к диссоциации – степень и константа диссоциации. Закон разбавления Оствальда. Изменение степени диссоциации слабого электролита при введении одноименных ионов или противоионов. Отклонение от законов Рауля и Вант-Гоффа коллигативных свойств разбавленных растворов электролитов. Особенности поведения сильных электролитов в растворах: понятия о меженном взаимодействии, ионной силе раствора, активности ионов и самого электролита.
Насыщенный раствор-раствор , в котором вещество при данной температуре уже не может растворятся, т.е. раствор имеет максимально возможную концентрацию вещества, характеризуется величиной произведение растворимости.
Ненасыщенный раствор-раствор, в котором концентрация растворенного вещества меньше, чем а насыщенном, т.е. можно дополнительно еще растворить вещество.
Перенасыщенный раствор- раствор, содержащий больше растворенного вещества , чем должно быть в насыщенном растворе при данной температуре.
Молярная масса- масса одного моля вещества или масса числа авогадо структурных единиц.
Молярная масса эквивалента- масса одного моля эквивалента вещества.
Вант-Гоффа закон: осмотического давления, определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества.
Выражение Р0А–РА= ? РА = Р0А· Nв количественно выражает связь между концентрацией растворенного вещества в растворе и давлением насыщенного пара растворителя над раствором. Его называют законом Рауля: понижение давления насыщенного пара растворителя А над раствором ?РА пропорционально мольной доле растворенного нелетучего вещества ·Nв.
Здесь Р0А и РА— давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором; ?РА – разность между давлениями насыщенного пара растворителя над растворомРА и растворителем Р0А. Из выражения закона Рауля следует, что с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
Электролит — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.
Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Шведский физико-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы - ионы, которые могут передвигаться к электродам - отрицательно заряженному катоду и положительно заряженному аноду. Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации. Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
НCl=Н++ Сl-;
СН3СООН=Н+ + СН3СОО-
Основностъ кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, НCl, HNO3 - одноосновные кислоты - образуется один катион водорода; Н2S, Н2СО3, Н2SO4 - двухосновные, а Н3РО4, Н3АsО4 - трехосновные, так как образуются соответственно два и три катиона водорода. Из четырех атомов водорода, содержащихся в молекуле уксусной кислоты СН3СООН, только один, входящий в карбоксильную группу - СООН, способен отщепляться в виде катиона Н+, - уксусная кислота одноосновная.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксидионы.
Например: диссоциация гидратация электролитический раствор
KOH= K+ + OH-;
NH4OH= NH+4 + OH-
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо. Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NН4ОН - однокислотное основание, Са(ОН)2 - двухкислотное, Fе(ОН)3 - трехкислотное и т.д. Двух- и многокислотные основания диссоциируют.
Ca(ОН)2Са(ОН)+ + OH - (первая ступень)
Ca(OH)+Ca2++OH - (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН - (в незначительных количествах):
Н2O= Н+ + ОН-
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н+, и щелочные свойства, обусловленные наличием ионов ОН-.
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
2ОН- + Zn2+ + 2Н2О Zn(ОН)2 + 2Н2О [Zn(ОН)4]2-+ 2Н+
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH+4) и анионы кислотных остатков:
(NH4)2SO4 2NH+4 + SO2-4;
Na3PO4 3Na+ + PO3-4
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4= K+ + HSO-4
HSO- 4=H++SO2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы:
Mg(OH) =Cl Mg(OH)++Cl-
Mg(OH) += Mg2++OH-
Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа б).
Степень диссоциации - это отношение числа распавшихся на ионы молекул N' к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если б = 0, то диссоциация отсутствует, а если б = 1 или 100%, то электролит полностью распадается на ионы. Если же б = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается 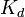 иобратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
иобратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
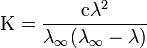
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
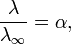
где α — степень диссоциации.
Описанные выше представления составляют основу теории межионного взаимодействия электролитов. Вкратце суть ее состоит в следующем: электростатическое притяжение между ионами существует во всех электролитах, но в слабых электролитах, где число ионов относительно мало и поэтому они находятся далеко друг от друга, оно несущественно. Таким образом, концепция межионного взаимодействия относится главным образом к сильным электролитам. В количественном виде эту концепцию представили П.Дебай и Э.Хюккель в 1923, и она называется теорией Дебая - Хюккеля. Основная ее идея состоит в том, что вследствие электростатического притяжения между положительными и отрицательными ионами вблизи каждого иона находятся главным образом ионы противоположного знака, т.е. ион как бы окружен ионной атмосферой. Суммарный заряд этой атмосферы по абсолютной величине равен заряду центрального иона, но противоположен ему по знаку.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
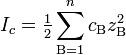 ,
,
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na+ и Cl− с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
I(NaCl) = 0,5(z²(Na+)•c(Na+) + z²(Cl−)•c(Cl−)) = 0,5(1²•c(NaCl) + (-1)²•c(NaCl)) = c(NaCl)
И ионная сила соответственно будет равна концентрации раствора:
I = 0.5(1²•0,001 моль/л + (-1)²•0,001 моль/л) = 0.5(0,001 моль/л + 0,001 моль/л) = 0,001 моль/л
Это верно для раствора любого сильного электролита, состоящего из однозарядных ионов. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде:
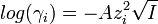 ,
,
где γ — коэффициент активности, А — постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
Различают активность электролита и активность ионов. Для любого электролита процесс диссоциации можно записать следующим образом:
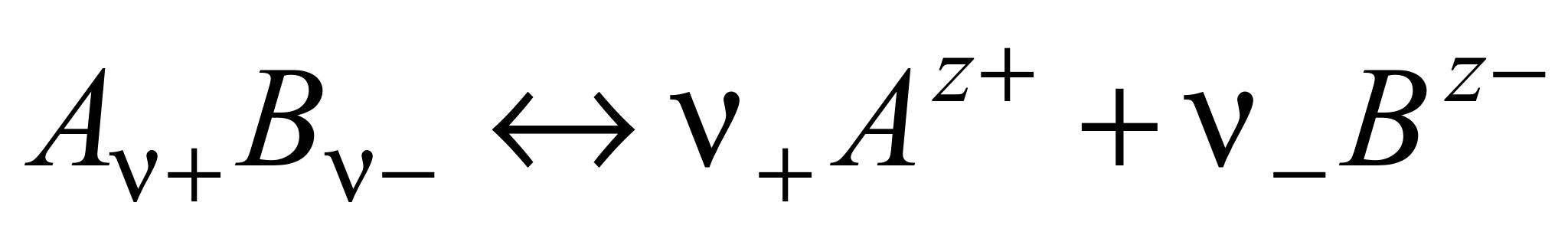 ,
,
n где + nи – — количество ионов А с зарядом z+ и ионов B c зарядом z–, на которые распадается исходная частица. Например, при диссоциации хлорида бария:
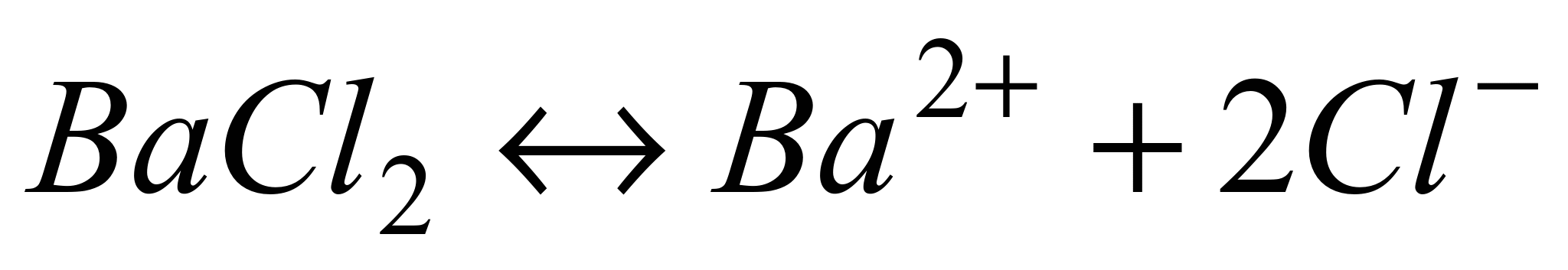
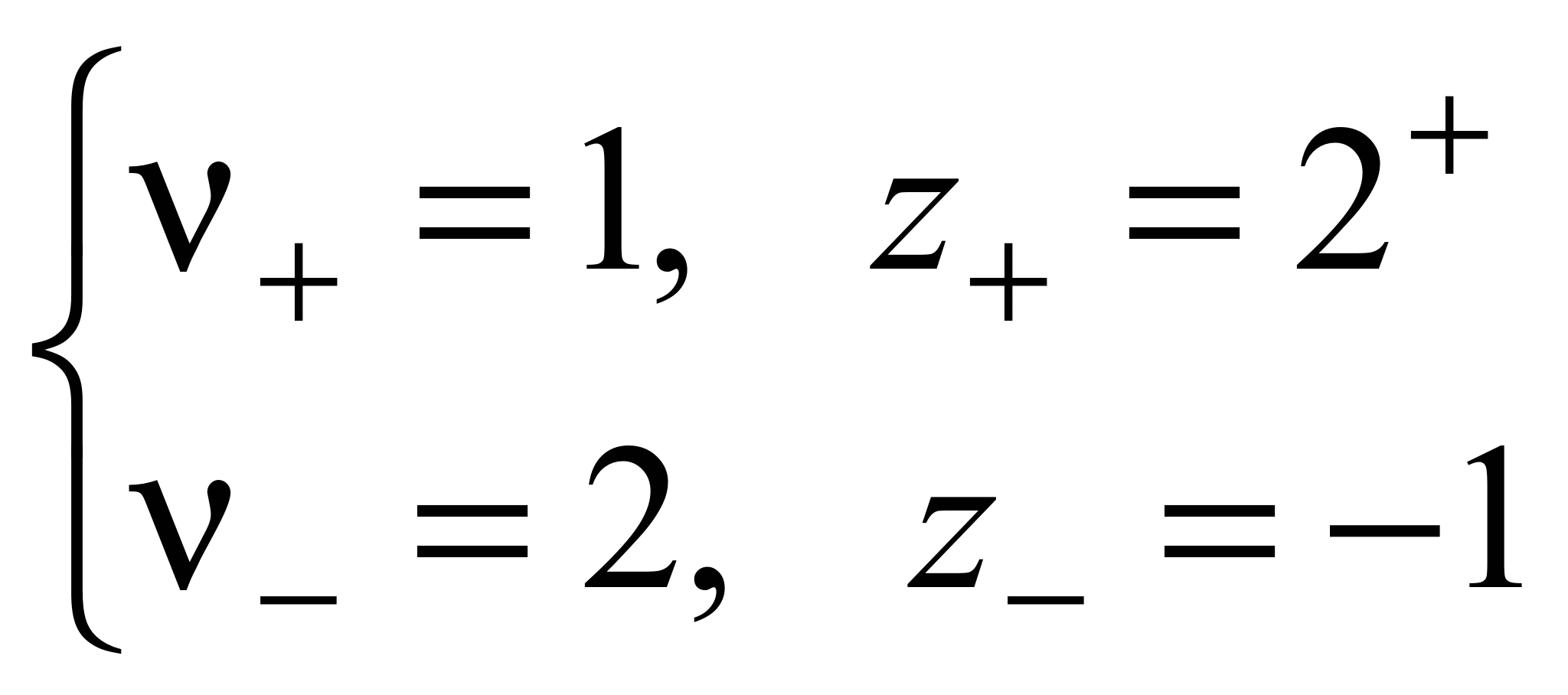 .
.
Связь активности электролита с активностями ионов выражается следующим соотношением:
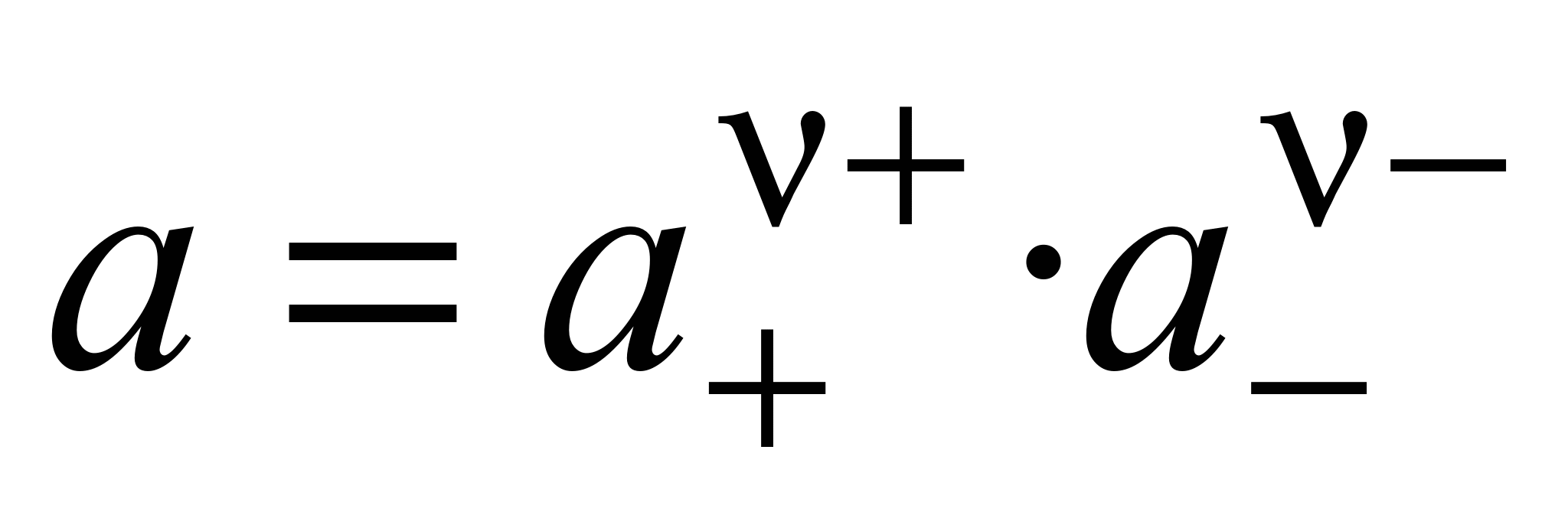 , (1.11)
, (1.11)
где а — активность электролита, а+ и а– — активности положительных и отрицательных ионов. Например, для бинарных электролитов справедливо:
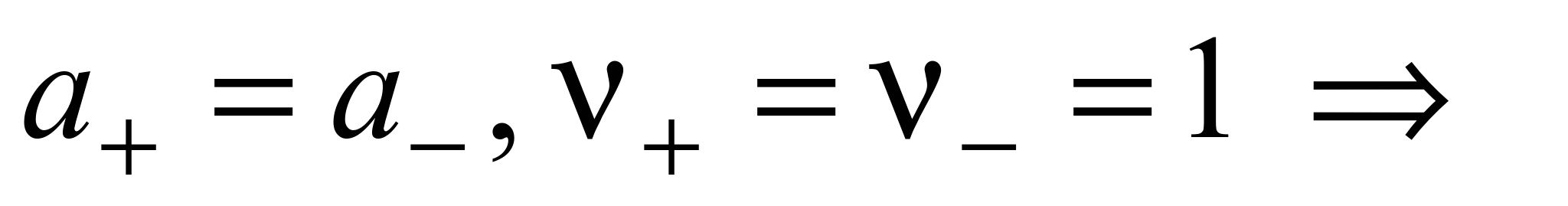
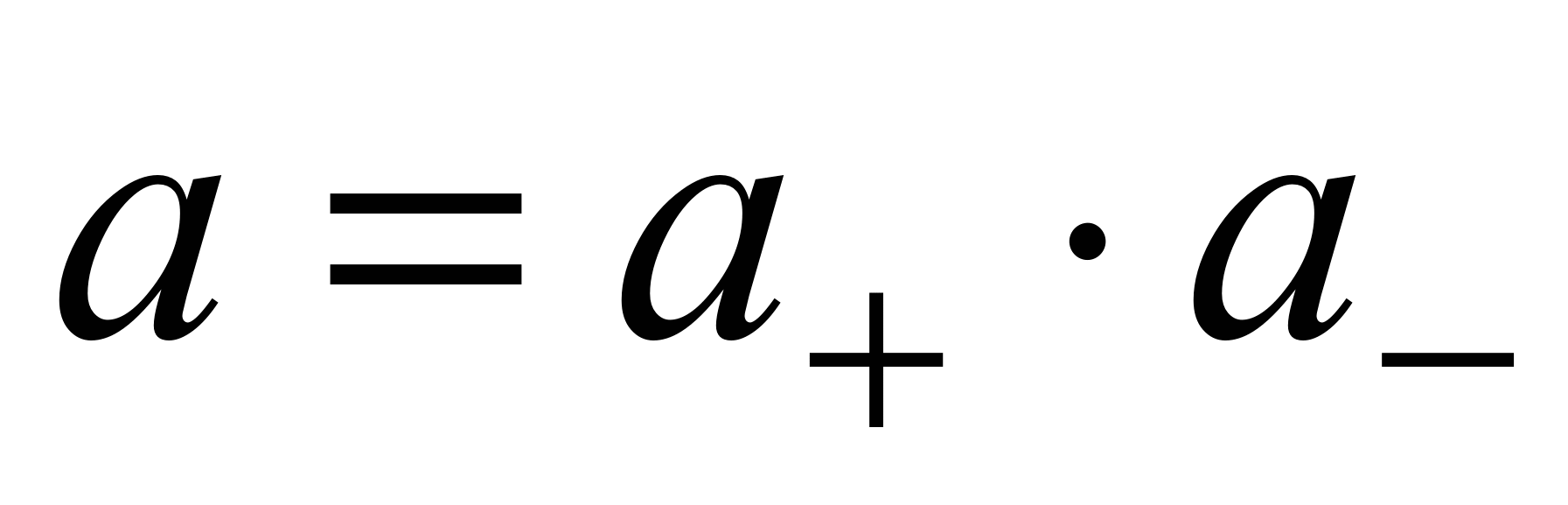 .
.
Экспериментальных методов определения активности отдельных ионов (а+ и а–) не существует. Поэтому было введено понятие средней ионной активности( 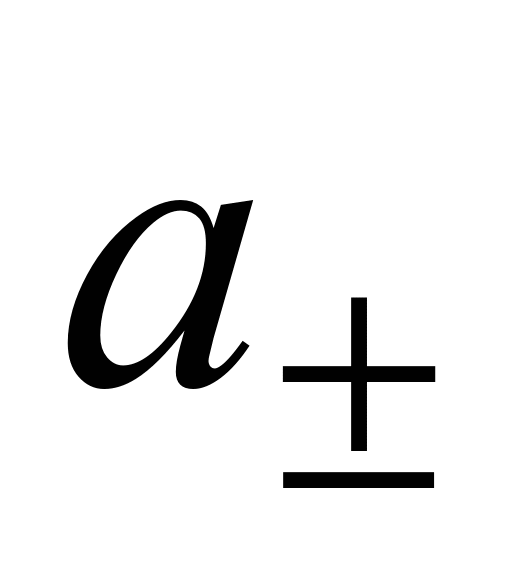 ), представляющей собой среднее геометрическое из активности отдельных ионов:
), представляющей собой среднее геометрическое из активности отдельных ионов:
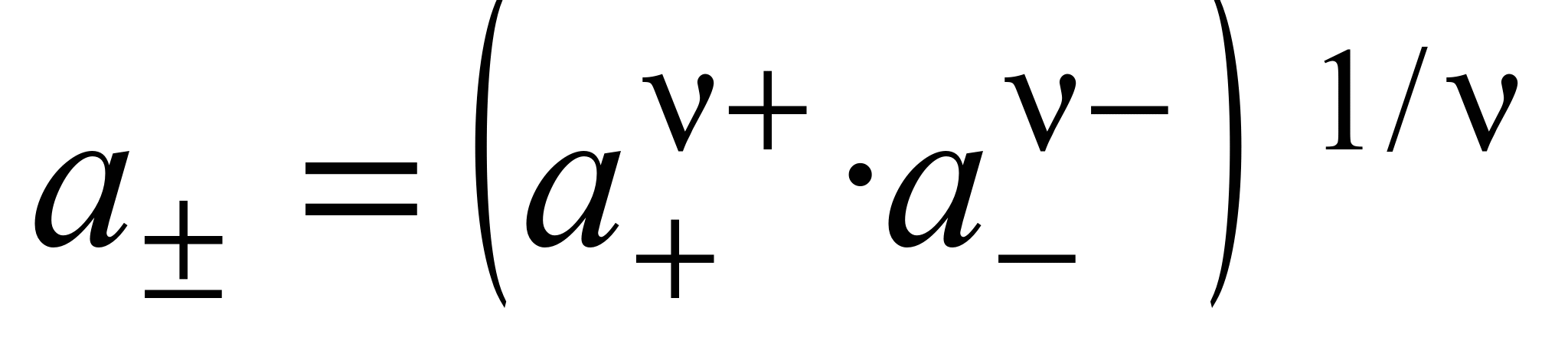 , (1.12)
, (1.12)
где 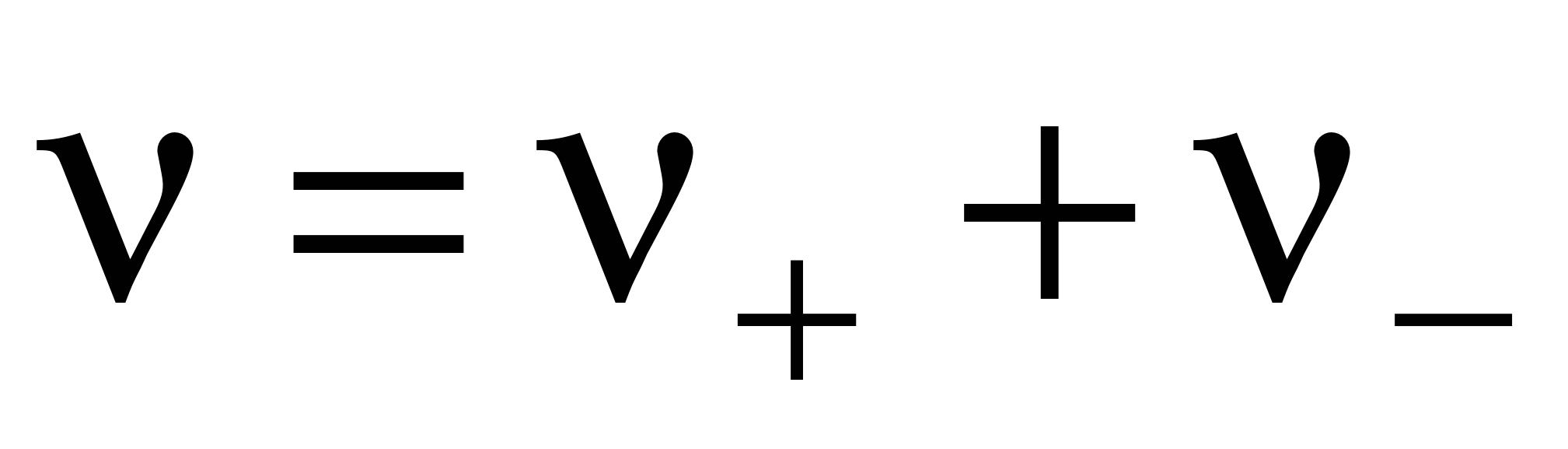 .
.
Тогда
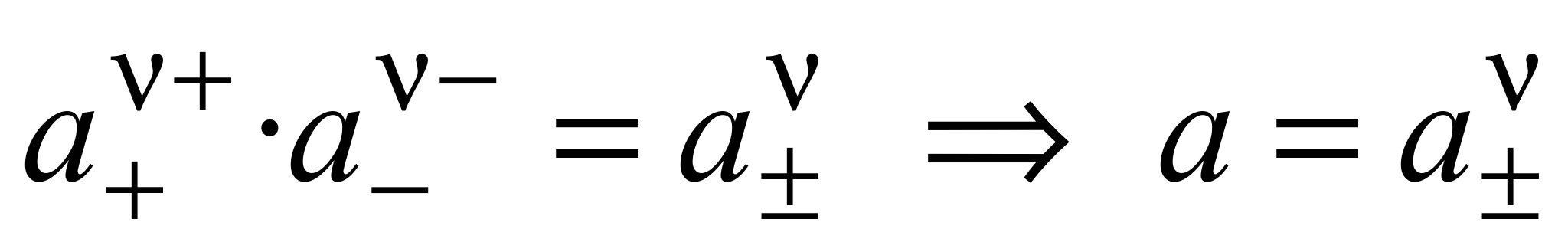 . (1.13)
. (1.13)
Криоскопический метод и метод, основанный на определении давления пара, позволяют определить активность электролита в целом (а) и по уравнению (7.13) найти среднюю ионную активность.
Средний ионный коэффициент активности ( 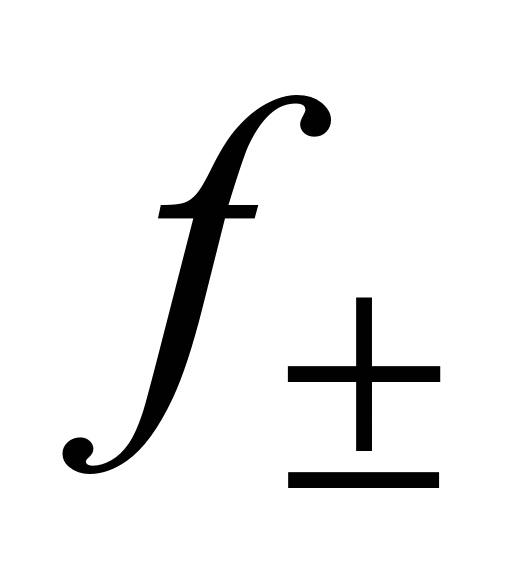 ) определяется выражением
) определяется выражением
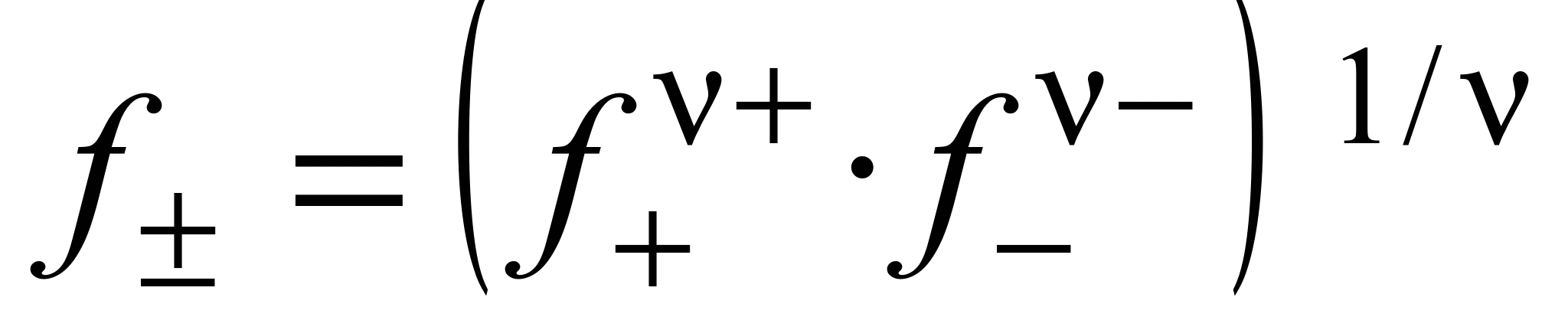 . (1.14)
. (1.14)
Значения 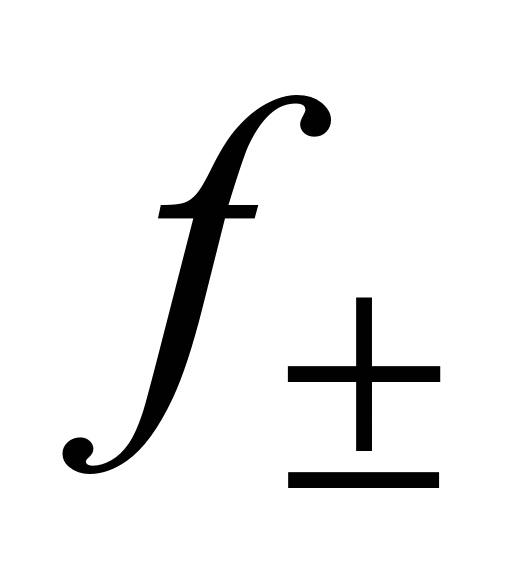 в основном определяют криоскопическим методом и методом Э.Д.С.
в основном определяют криоскопическим методом и методом Э.Д.С.
Средняя ионная моляльность ( 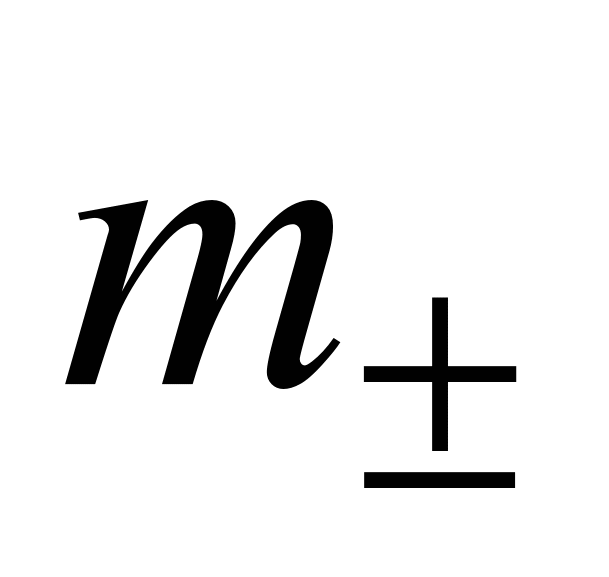 ) определяется как
) определяется как
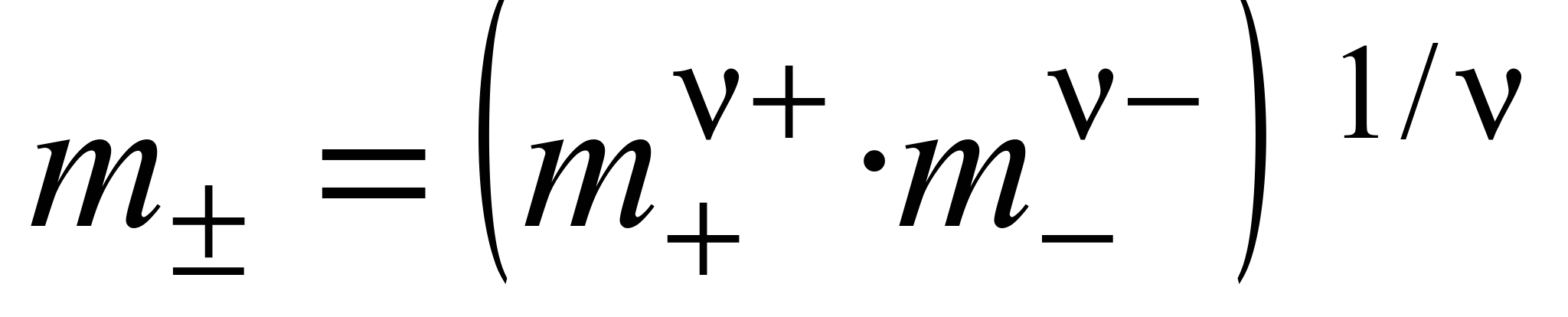 . (1.15)
. (1.15)
Если концентрацию раствора выражать через моляльность, то
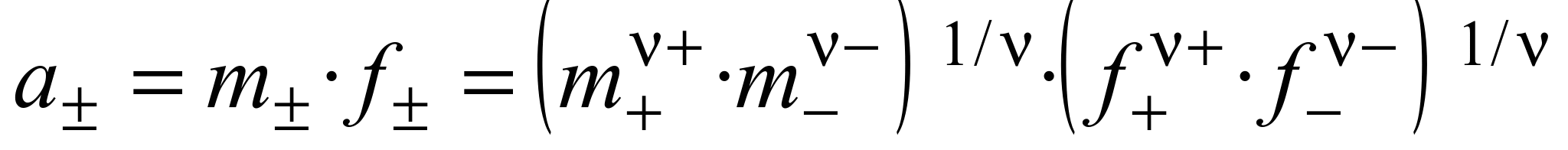 .
.
Пример 1.1. Найти связь между активностью электролита, его моляльной концентрацией и средним ионным коэффициентом активности для р-ров NaCl иNa2CO3 моляльности m.
а) Концентрации ионов, образующихся при полной диссоциации NaCl, равны m:
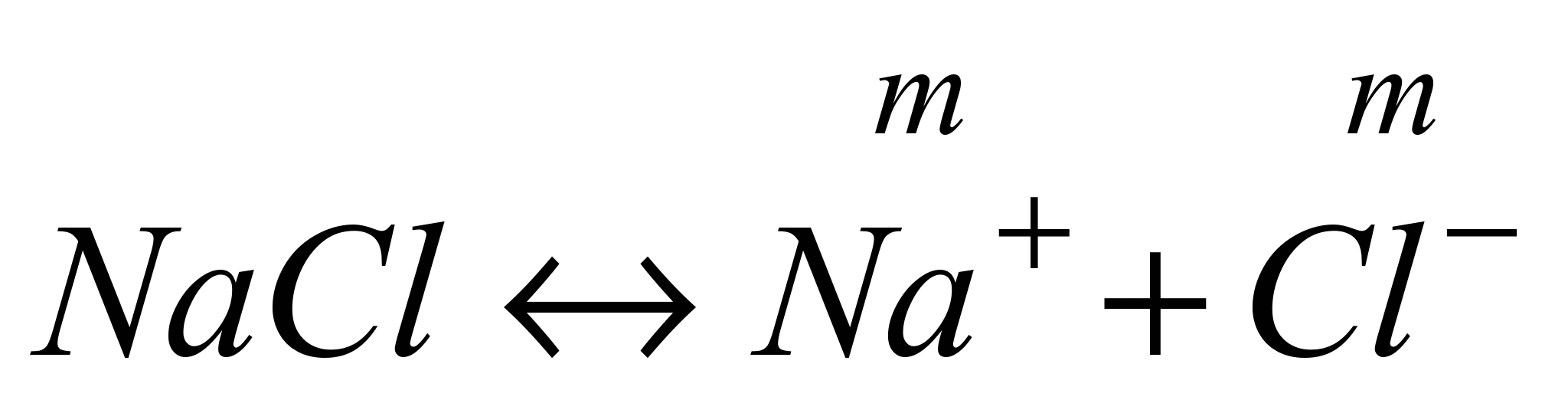 .
.
nТак как + n= – = 1, то
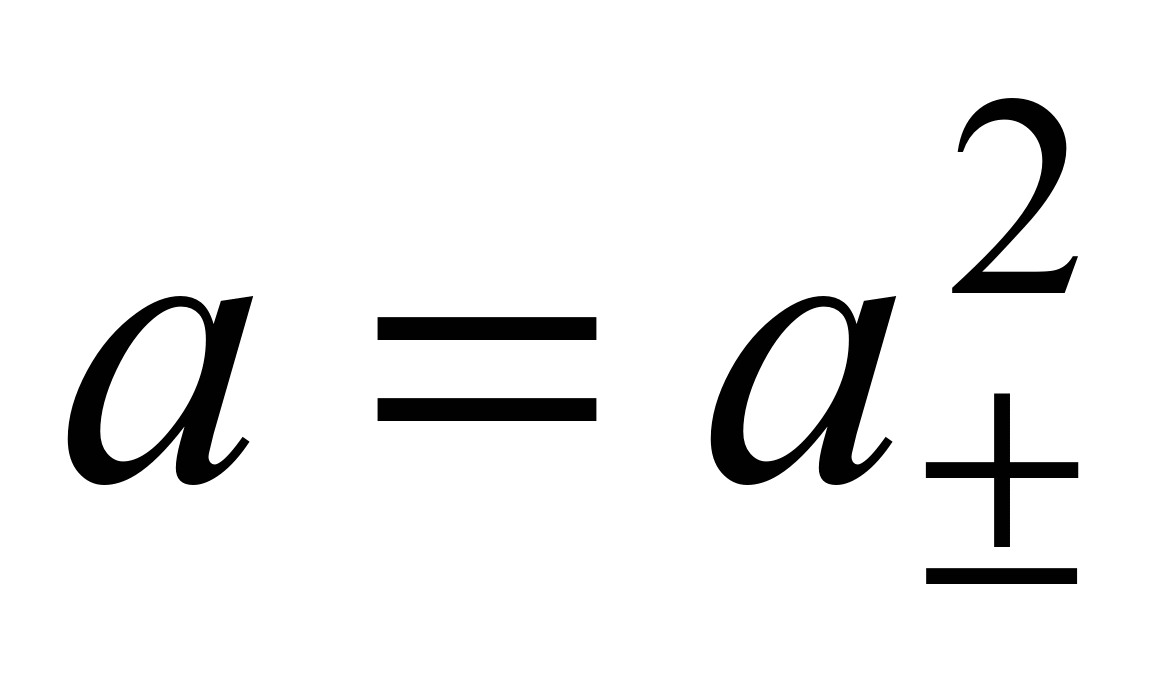 .
.
Для равновалентных электролитов средняя моляльность будет равна общей моляльности электролита:
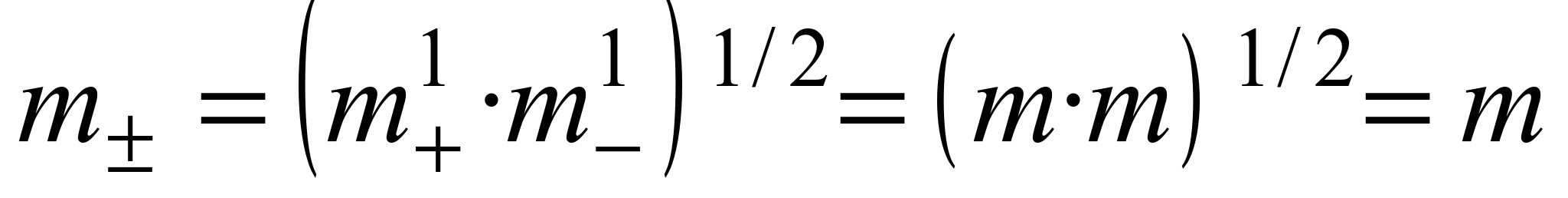 .
.
Тогда
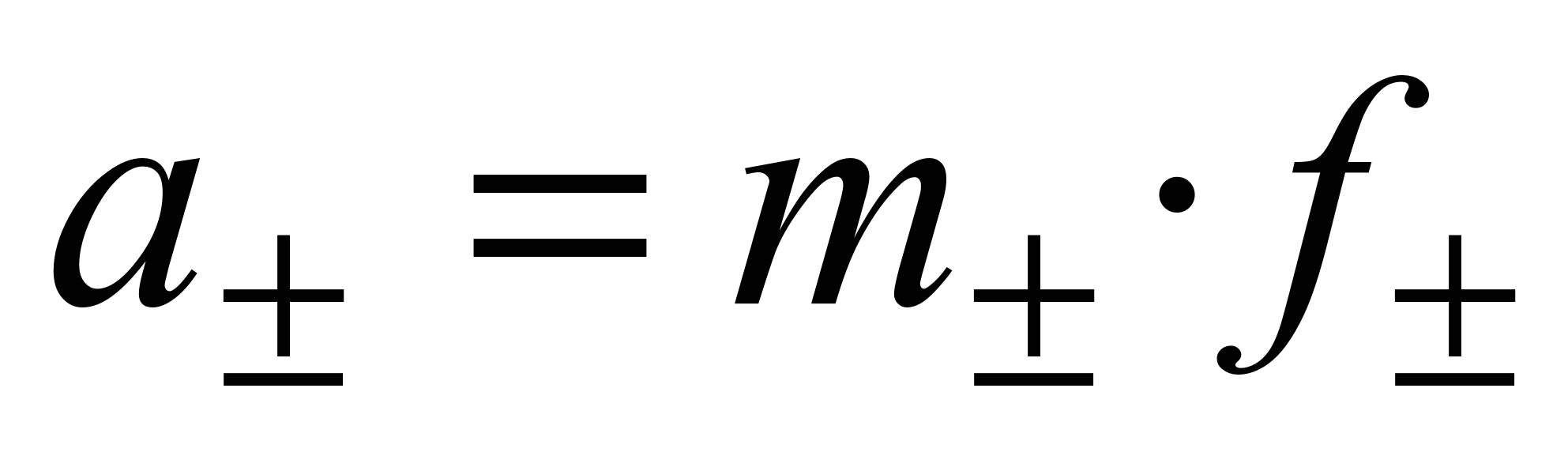 ,
,
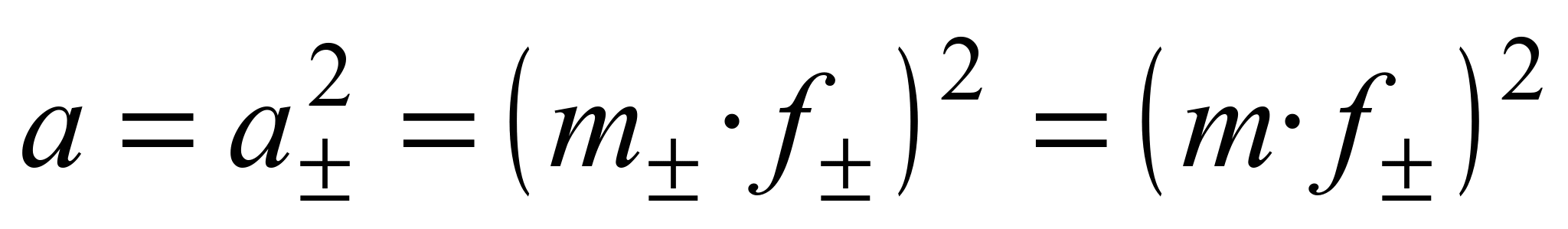 .
.
Электролитическая диссоциация воды. Ионное произведение воды (константа воды), зависимость от температуры. Водородный показатель среды рН. Качественные и количественные способы измерения рН водных растворов.
По величине электрической проводимости чистой воды можно вычислить концентрацию ионов гидроксония Н3О+ и гидроксид-ионов в воде. При 25º С она равна 10‾7 моль/л.
Константа диссоциации воды может быть вычислена по уравнению
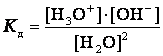 ,
,
для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов гидроксония и гидроксид-ионов есть величина постоянная. Она называется ионным произведением воды.
Численное ее значение можно получить, если подставить концентрации ионов гидроксония и гидроксид-ионов. В чистой воде при 25ºС [H3O+] = [OH‾] = 1·10‾7 моль/л. Поэтому для указанной температуры:
Кв = 10‾7.10‾7 =10‾14.
Диссоциацию воды часто записывают в более простом виде:
Н2О = Н+ + ОН‾.
Кв – не зависит от концентрации ионов Н+ и ОНˉ. Так, если в воду добавить кислоты, концентрация ионов Н+ резко возрастет. Тогда за счет подавления диссоциации воды равновесие этого процесса сместится влево и концентрация ионов ОНˉ уменьшится, но ионное произведение воды останется неизменным.
В соответствии теорией электролитической диссоциации ионы Н+ являются носителями кислотных свойств, а ионы ОНˉ - носителями основных свойств. Поэтому раствор будет нейтральным, когда
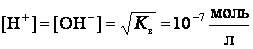 ;
;
кислым, когда
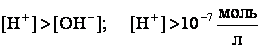 ;
;
и щелочным, когда
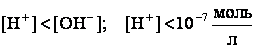
Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель, или pH.
Водородным показателем, или pH, называется взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
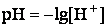
рН-метр в воде фиксирует значение рН = 6,55.
В абсолютно чистой воде концентрация Н+ равна концентрации ионов ОН– и имеет значение 10–7 моль/л (при 25° С).
НОН ↔ H+ + OH–
В чистой воде рН = 7.
Но в воде растворяется незначительное количество углекислого газа, присутствующего в воздухе. Из-за растворенного СО2 вода становится слегка кислой.
CO2 + НОН ↔ HCO3– + H+
Поэтому рН-метр фиксирует концентрацию Н+, чуть большую, чем в чистой воде.
Чем больше концентрация Н+, тем значение рН меньше.
