Реакции ионного обмена в растворах электролитов; способы их написания. Условия необратимого протекания таких реакций. Явление амфотерности. Амфотерные гидроксиды в рекциях ионного обмена.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями,а уравнения этих реакций - ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок)и газообразные записываются в молекулярной форме. Знак ↓, стоящий при формуле вещества, обозначает, что это вещество уходит из сферы реакции в виде осадка, знак ↑обозначает, что вещество удаляется из сферы реакции в виде газа. Сильные электролиты, как полностью диссоциированные, записывают в виде ионов.Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части.
Условия необратимости реакций ионного обмена
1. Если образуется осадок (Ї) (смотри таблицу растворимости)
Pb(NO3)2 + 2KI ®--PbI2Ї + 2KNO3
Pb2+ + 2I- ® PbI2Ї
2. Если выделяется газ ()
Na2CO3 + H2SO4 ® Na2SO4 + H2O + CO2
CO32- + 2H+ ® H2O + CO2
3. Если образуется малодиссоциированное вещество (H2O)
Ca(OH)2 + 2HNO3 ®--Ca(NO3)2 + 2H2O
H+ + OH- ®--H2O
4. Если образуются комплексные соединения (малодиссоциированные комплексные ионы)
CuSO4 * 5H2O + 4NH3 ® [Cu(NH3)4]SO4 + 5H2O
Cu2+ + 4NH3 ® [Cu(NH3)4]2+
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений (H2O) или комплексных ионов реакции обмена обратимы Амфотерность — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Амфотерные гидроксиды – это нерастворимые в воде соединения типа Ме(ОН)n, которые взаимодействуют как с растворами кислот, так и с растворами щелочей. Реагируя с растворами кислот, они проявляют основные свойства:
Zn(OH)2 + 2HCl = 2H2O + ZnCl2;
Zn(OH)2 + 2H+ + 2Cl- = 2H2O + Zn2+ +2Cl-;
Zn(OH)2 + 2H+ = 2H2O + Zn2+.
Реагируя с растворами щелочей, они проявляют кислотные свойства, при этом образуются гидроксокомплексные соединения:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4];
Zn(OH)2 + 2Na+ + 2OH- = [Zn(OH)4]2- + 2Na+;
Zn(OH)2 + 2OH- = [Zn(OH)4]2-.
Типы гидролиза солей. Сущность процесса гидролиза. Расчет степени и константы гидролиза солей разного состава (средних, кислых, основных). Факторы, влияющие на степень гидролиза солей, - усиливающие или подавляющие гидролиз.
Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз, дословно, - это разложение водой. Давая такое определение реакции гидролиза солей, мы подчеркиваем, что соли в растворе находятся в виде ионов, и что движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос с учениками, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут, следовательно, в реакцию гидролиза не вступают.
Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
1. гидролиз по катиону (в реакцию с водой вступает только катион);
2. гидролиз по аниону (в реакцию с водой вступает только анион);
3. совместный гидролиз (в реакцию с водой вступает и катион, и анион);
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
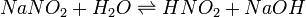
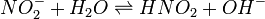
Уравнение константы равновесия для данной реакции имеет вид:
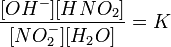 или
или 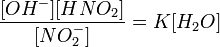
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 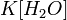 можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:
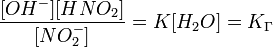
Численное значение константы гидролиза получим, используя ионное произведение воды 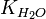 и константу диссоциации азотистой кислоты
и константу диссоциации азотистой кислоты 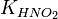 :
:
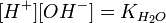
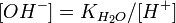
подставим в уравнение константы гидролиза равна:
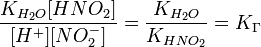
В общем случае для соли, образованной слабой кислотой и сильным основанием:
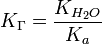 , где
, где 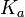 — константа диссоциации слабой кислоты, образующейся при гидролизе
— константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
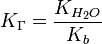 , где
, где 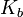 — константа диссоциации слабого основания, образующегося при гидролизе
— константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
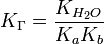
Гетерогенные равновесия в растворах малорасторимых электролитов. Понятие о произведении растворимости (ПР) и растворимости (S) электролита; связь между ними. Зависимость растворимости от величины ПР. Понятие о произведении равновесных концентраций ионов (ПК). Насыщенный, ненасыщенный и пересыщенный растворы. Условия выпадения и растворения осадков.
ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
При соприкосновении твердого вещества с растворителем вещество начинает растворяться и по установлении термодинамического равновесия образуется насыщенный раствор. В случае малорастворимого электролита в водном растворе, насыщенном относительно малорастворимого электролита, устанавливается равновесие:
МтАп„(тв.) ч=ь МтАп„(раств.) ч=ь тМ"+ + лАгГ".
Для системы, находящейся в состоянии равновесия, изменение энергии Гиббса AG равно нулю, т. е.
0(раств.) — G(TB.) = ДО = 0 И G (раств.) = G(TB.), G° (тв.)+/?Лпа(тв.) = тО°м«++ЯПп afr+ + лО°п„_-т-ЯЛпо?п„_.
Величина а(тв.) = 1;
G0 (тв.) = mGM,+ + nGAn,- = RT(\n ам*+ + ln aj„.-), гД G°/RT=\n ам.+ +1п аЯ„- , где z — общее обозначение стехиометрических коэффициентов.
Взаимосвязь термодинамической константы равновесия процесса с G" выражается уравнением ДО°=-ЯПп Ка-
Тогда для константы равновесия рассматриваемого процесса получим выражение:
К«=вм-+аАп- = ПРм.А„, (228) где ПРМл1дПя — произведение растворимости, т. е. произведение активностей ионов малорастворимого вещества MmAn„ в его насыщенном растворе.
Так как ам.+ = ум"+ [Мя+] и аАп- = уАп- [Апт~], то ПРм„Ап„=7м-+ 1 тУ\п«- [An"1" ].
Для соединений с растворимостью S меньше 10—5Af можно принять ам»+=[М"+] и aAn—=[Апт~] (так как ум.+ и уАп'~ близки к единице), тогда
ПРм„Ап„=[М"+Г[Ап"-]". (2.29)
В насыщенном растворе, находящемся над осадком, кроме иоиов малорастворимого электролита существуют его иеднс-социироваииые молекулы, в ряде случаев могут образовываться иоииые комплексы различного состава и т. д. Поэтому для описания растворимости осадков в реальных условиях целесообразно использовать условное произведение растворимости ПР)5цАп11, которое представляет собой произведение суммарных равновесных концентраций всех форм катиона и аниона осадка в его насыщенном растворе:
прУм:Ап„=См-САп.-.' (2.30)
В зависимости от значения коистаит конкурирующих равновесных реакций (гидролиза, протонирования, комплексообразования и др.) и устойчивости образуемых ими соединений, равновесная концентрация форм катиона [М"+] и аииоиа [Апш~] всегда меньше их общей равновесной концентрации См«+ и САп—.
Вводя величины <хм.+ = СМ«+/ [М"+] и ОСА„— = САП.-/ /[Anm~] в уравнение (2.30), получим зависимость между ПР и ПРусл:
ПРЙ1Ап. = ПРм.Ап.«> + вАп-. (2.31)
где а^«+ и аАпт- — коэффициенты конкурирующих (побочных) реакций.
Если произведение концентраций иоиов реагирующих веществ, находящихся в растворе, меньше произведения растворимости малорастворимого электролита — продукта их реакции ([M"+]m[Anm~]" > ПРМтАпя раствор пересыщен, происходит выпадение осадка.
Зиая произведение растворимости малорастворимого электролита, можно рассчитать его растворимость в воде
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
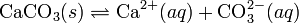
Константа этого равновесия рассчитывается по уравнению:
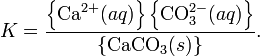
Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Произведение растворимости связано с растворимостью следующим соотношением:
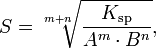
Насыщенный раствор-раствор , в котором вещество при данной температуре уже не может растворятся, т.е. раствор имеет максимально возможную концентрацию вещества, характеризуется величиной произведение растворимости.
Ненасыщенный раствор-раствор, в котором концентрация растворенного вещества меньше , чем а насыщенном, т.е. можно дополнительно еще растворить вещество.
Перенасыщенный раствор- раствор, содержащий больше растворенного вещества, чем должно быть в насыщенном растворе при данной температуре.
Условие выпадения осадка только одно: произведение концентраций соответствующих ионов в степенях стехиометрических коэффициентов больше, чем произведение растворимости соли при данной температуре.
Классификация и номенклатура комплексных соединений. Понятия о центральном атоме (ион-комплексообразователь), лигандах, координационном числе, геометрии комплексной частицы. Диссоциация комплексных соединений в водных растворах по двум ступеням. Константы нестойкости комплексных соединений. Образование и разрушение комплексных соединений.
Существует несколько классификаций комплексных соединений в основу которых положены различные принципы.
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
