Равновесия в реакциях ионного обмена
Обязательным условием течения реакций между электролитами является удаление из раствора тех или иных ионов вследствие образования слабодиссоциирующих веществ, или веществ, выделяющихся из раствора в виде осадка или газа.
Если исходные вещества в реакции ионного обмена являются хорошо растворимыми сильными электролитами, то равновесие таких реакций практически полностью смещено в сторону образования малорастворимых, малодиссоциированных или газообразных продуктов. Поэтому такие реакции можно считать практически необратимыми:
FeCl2 + 2 NaOH ® Fe(OH)2¯ + 2 NaCl или Fe2+ + 2 OH– ® Fe(OH)2¯;
HCl + NaOH ® NaCl + H2O или H+ + OH– ® H2O;
Na2CO3 + 2 HCl ® 2 NaCl + H2O + CO2 или CO32– + 2 H+ ® H2O + CO2.
Если же среди исходных веществ, участвующих в обменной реакции, есть слабый электролит или малорастворимое вещество, то такая реакция может быть обратимой.
Например, в реакции взаимодействия уксусной кислоты с сульфидом натрия 2 CH3COOH + Na2S ⇆ 2 CH3COONa + H2S
в растворе сосуществуют два слабых электролита – уксусная кислота и сероводородная кислота: 2 CH3COOH + S2– ⇆ 2 CH3COO– + H2S .
Ионы водорода могут в данной реакции связаться сульфид-ионами в молекулы сероводородной кислоты или ацетат-ионами в молекулы уксусной кислоты. Ионы CH3COO– и S2– конкурируют друг с другом в связывании ионов водорода.
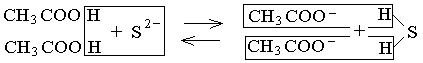
Поэтому в данном случае реакция протекает обратимо. Равновесие этой реакции сильно смещено вправо, поскольку сероводородная кислота – более слабый электролит (K1 H2S = 6·10–8, K2 H2S = 1·10–14), чем уксусная кислота (KCH3COOH = =1,8·10–5), и связывание ионов H+ в молекулы сероводородной кислоты происходит полнее, чем в молекулы уксусной кислоты.
Обратимыми также являются реакции, в ходе которых малорастворимое вещество превращается в растворимый, но слабодиссоциирующий продукт. Примером такой реакции является взаимодействие сульфида цинка с соляной кислотой ZnS (твёрдый) + 2 HCl ⇆ ZnCl2 + H2S (раствор) .
С одной стороны, при образовании слабого электролита H2S связываются ионы S2–, что способствует протеканию реакции ZnS + 2 H+ ⇆ Zn2+ + H2S
вправо. С другой стороны, присутствие среди исходных веществ малорастворимого электролита ZnS, при образовании которого также связываются ионы S2– обусловливает протекание этой реакции влево. 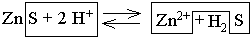 Таким образом, конкуренция ионов H+ и Zn2+ за сульфид-ионы приводит к установлению равновесия.
Таким образом, конкуренция ионов H+ и Zn2+ за сульфид-ионы приводит к установлению равновесия.
Направление рассматриваемой реакции зависит от того, какое из двух веществ H2S или ZnS прочнее связывает ионы S2–. Общая константа диссоциации сероводорода K = K1·K2 = 6·10–22 превышает произведение растворимости ZnS (ПР = 1,6·10–24). Следовательно, сульфид-ионы несколько сильнее связываются ионами цинка, чем ионами водорода, и равновесие данной реакции слегка смещено влево.
В реакции AgCl (твёрдый) + NaI ⇆ AgI (твёрдый) + NaCl равновесие устанавливается вследствие конкуренции хлорид- и иодид-ионов за ионы Ag+.
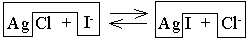
ПР(AgI) =10–16 < ПР(AgCl) =2·10–10, следовательно, иодид серебра является менее растворимым веществом, чем хлорид серебра, и более полное связывание ионов серебра происходит в результате образования иодида серебра. Поэтому равновесие рассматриваемой реакции смещено вправо.
Приведённые примеры иллюстрируют общее правило: равновесие реакции ионного обмена смещено в сторону образования менее растворимого или менее диссоциированного вещества.
Л Е К Ц И Я 8
ГИДРОЛИЗ СОЛЕЙ
