Применение алканов на основе свойств.
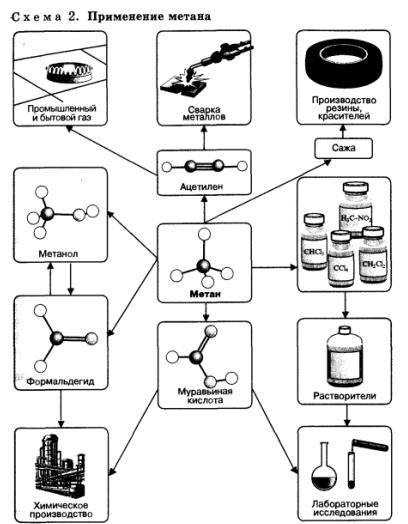 Предельные углеводороды, в особенности метан, находят очень широкое применение в промышленности (схема 2). Они являются простым и достаточно дешевым топливом, сырьем для получения большого количества важнейших соединений.
Предельные углеводороды, в особенности метан, находят очень широкое применение в промышленности (схема 2). Они являются простым и достаточно дешевым топливом, сырьем для получения большого количества важнейших соединений.
Соединения, полученные из метана, самого дешевого углеводородного сырья, применяют для получения множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений.
Вопросы для самоконтроля
1. Составьте формулы ближайших гомологов для состава С5Н12.
2. Составьте молекулярные формулы углеводородов ряда метана, в молекулах которых содержатся:
а) 12 атомов углерода;
б) 30 атомов водорода.
3.Определите молекулярную формулу алкана, молекулярная масса, которого 30 г/моль.
4. Если вы усвоили номенклатуру алканов, то сможете самостоятельно назвать каждый из них. Перепишите в тетрадь структурные формулы алканов, приведенные в задании и назовите эти вещества.
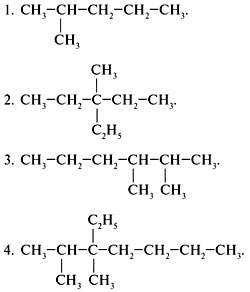
5. Напишите структурные формулы следующих веществ:
а) 2,3 – диметилбутана,
б) 2,4 – диметил - 3 – этилпентана
в) н – пентана
6. Составьте структурные формулы предельных углеводородов по приведенным углеродным скелетам и назовите их по систематической номенклатуре:
а) С – С – С – С
|
С
б) С – С – С – С – С
| |
С С
в) С – С – С – С – С
|
С
г) С – С – С – С – С
| |
С С
ПЛАН ЗАНЯТИЯ № 6
Дисциплина:Химия.
Тема:Алкены.
Цель занятия:Изучить класс органических соединений - алкены, их свойства, строение и применение.
Планируемые результаты
Предметные: владенть основополагающими химическими понятиями, понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
Метапредметные: ументь оценивать ее достоверность информации для достижения хороших результатов в профессиональной сфере;
Личностные: умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности.
Норма времени:2 часа
Вид занятия:Лекция
План занятия:
1. Этилен, его получение (дегидрированием этана, деполимеризацией полиэтилена).
2. Гомологический ряд, изомерия, номенклатура алкенов.
3. Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация.
4. Применение этилена на основе свойств
Оснащение:Учебник.
Литература:
11. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
12. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 - изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель:Тубальцева Ю.Н.
Тема 6. АЛКЕНЫ.
План:
1) Этилен, его получение (дегидрированием этана, деполимеризацией полиэтилена).
2) Гомологический ряд, изомерия, номенклатура алкенов.
3) Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация.
4) Применение этилена на основе свойств
1. Этилен, его получение (дегидрированием этана, деполимеризацией полиэтилена).
Этилен впервые был получен немецким химиком Иоганном Бехером в 1680 году при действии купоросного масла на винный спирт. Вначале его отождествляли с "горючим воздухом", т.е. с водородом. Позднее, в 1795 году этилен подобным же образом получили голландские химики Дейман, Потс-ван-Труствик, Бонд и Лауеренбург и описали под названием "маслородного газа", так как обнаружили способность этилена присоединять хлор с образованием маслянистой жидкости - хлористого этилена ("масло голландских химиков").
Изучение свойств этилена, его производных и гомологов началось с середины ХIХ века. Начало практическому использованию этих соединений положили классические исследования А.М. Бутлерова и его учеников в области непредельных соединений и особенно созданная Бутлеровым теория химического строения. В 1860 году он получил этилен действием меди на йодистый метилен, установив структурную формулу этилена.
Этилен представляет собой бесцветный газ, обладающий слабым, едва ощутимым запахом. Он плохо растворим в воде (при 0°С в 100 г воды растворяется 25,6 мл этилена), горит светящимся пламенем, образует с воздухом взрывчатые смеси. Термически менее устойчив, чем метан.
В природных газах (за исключением вулканических) этилен не встречается. Он образуется при пирогенетическом разложении многих природных соединений, содержащих органические вещества. Процесс пиролиза для получения этилена осуществляется в печах различного устройства пропусканием газообразных углеводородов или их паров в присутствии катализаторов при температуре 760-780°С. Обычно используются печи трубчатого типа. Этилен можно также получить дегидрированием этана:
2СН4 t° С2Н4 + 2Н2
и осторожным гидрированием ацетилена:
С2Н2 + Н2 кат С2Н4
В лаборатории этилен получают двумя способами: деполимеризацией полиэтилена ,
или каталитической дегидратацией этилового спирта. В качестве катализатора используют белую глину или чистый оксид алюминия: Распознают этилен по обесцвечиванию подкисленного раствора перманганата калия или бромной воды.
( - СН2 – СН2 -)n ® n СН2 = СН2
С2Н5ОН ® С2Н4 + Н2О
