Алгоритм решения термохимических задач
Последовательность действий:
Данные из условия задачи написать над уравнением реакции
Под формулой вещества написать его количество (согласно коэффициенту); произведение молярной массы на количество вещества. Над количеством теплоты в уравнении реакции поставить х.
Составить пропорцию.
Вычислить х.
Записать ответ.
Пример:
Сколько теплоты выделится при растворении 200 г оксида меди (II) (СuO) в соляной кислоте (водный раствор HCl), если термохимическое уравнение реакции: CuO + 2HCl = CuCl2 + H2O + 63,6 кДж
| Последовательность выполнения действий | Оформление решения задачи |
| 1.С помощью соответствующих обозначений запишем условие задачи, найдём молярную массу вещества, масса которого указана в условии задачи. | Дано: m(СuO) = 200 г Q - ? М(СuO) = 80 г/моль |
| 2. Найдём количество вещества оксида меди (II) по условию задачи. | Решение: n = m/М n = 200г/80 г/моль = 2,5 моль |
| 3.Составим уравнение реакции. Над формулами веществ запишем найденные количества веществ, а под формулами – молярные соотношения по уравнению реакции | 2,5 моль х кДж CuO + 2HCl = CuCl2 + H2O + 63,6 кДж 1 моль 63,6 кДж |
| 4. Составим пропорцию. | 200/80=х/63,6 |
| 5. Найдём значение х | х = 159 кДж |
| 6. Запишем ответ. | Ответ: 159 кДж |
Задачи для самостоятельного решения
1. Количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, термохимическое уравнение которой:
2 Mg + O2 = 2MgO + 1204 кДж, равно
а) 602 кДж б) 301 кДж в) 2408 кДж г) 1803 кДж
2. В реакцию, термохимическое уравнение которой S + O2 = SO2 + 297 кДж, вступила сера массой 1 г. Количество теплоты, выделившееся при этом, равно:
а) 9,28 кДж б) 2,97 кДж в) 29,7 1 кДж г) 74,25 кДж
3. Какое количество теплоты выделится при сгорании графита массой 2,4 г, если термохимическое уравнение реакции C + O2 = CO2 + 402 кДж?
а) 984 кДж б) 40,2 кДж в) 98,4 кДж г) 80,4 кДж
4. Термохимическое уравнение горения фосфора: 4P + 5O2 = 2P2O5 + 3010 кДж. Какое количество теплоты выделится при сгорании 62 г фосфора?
а) 6020 кДж б) 752,5 кДж в) 301кДж г) 1505 кДж
5. Какое количество теплоты выделится при сгорании метана объемом 5,6 л (н.у.), если термохимическое уравнение реакции СН4 + 2О2 = СО2 + 2Н2О + 892 кДж?
а) 22,3 кДж б) 2,23 кДж в) 223 кДж г) 446 кДж
6. Сколько теплоты выделится при растворении 200 г оксида меди (II) (СuO) в соляной кислоте, если термохимическое уравнение реакции: CuO + 2HCl = CuCl2 + H2O + 63,6 кДж
а) 159 кДж б) 318 кДж в) 15,9кДж г) 636 кДж
7. В результате реакции, термохимическое уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Масса сгоревшего ацетилена составила:
а) 13 г б) 26 г в) 52г г) 5,2г
8. В результате горения 48 г метана выделилось 2406 кДж теплоты. Количество теплоты, указанное в термохимическом уравнении этой реакции составит:
а) 401 кДж б) 802 кДж в) 1203кДж г) 4812 кДж
9. На разложение бертолетовой соли по реакции, термохимическое уравнение которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
было затрачено 182 кДж теплоты. Объем кислорода (при н.у.) выделившийся при этом, составил:
а) 134,4л б) 44,8л в) 89,6л г) 179,2л
10. В результате реакции, термохимическое уравнение которой H2+ Cl2 = 2HCl + 184,36 кДж, выделилось 921,8 кДж теплоты. Объем хлора, затраченный на образование хлороводорода (при н.у.) при этом составил:
а) 134,4л б) 112л в) 44,8л г) 96л
11. Согласно термохимическому уравнению реакции 2СО(г) + О2(г) = 2СО2(г) + 566 кДж при сжигании оксида углерода (II) выделилось 424,5 кДж теплоты. Объем (н.у.) сгоревшего газа составил
а) 66,2 л б) 33,6 л в) 44,8 л г) 12 л
12. Согласно термохимическому уравнению реакции 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O + 385 кДж, при получении 15,68 л NO (н.у.), количество выделившейся теплоты составило:
а) 358 кДж б) 716 кДж в) 134,75 кДж г) 22,4 кДж
13. По термохимическому уравнению реакции 2Сu + О2 = 2СuО + 311 кДж вычислите. Количество теплоты, которая выделится при окислении 384 г меди, составит:
а) 622 кДж б) 716 кДж в) 466,5 кДж г) 933 кДж
14. В результате реакции, термохимическое уравнение которой
2Cl2O7 = 2Cl2 + 7O2 + 574 кДж, выделилось 5,74 кДж теплоты. Объем образовавшегося при этом кислорода (н.у.) составил:
а) 100 л б) 0,224 л в) 1,568 л г) 4,48 л
15. В реакцию, термохимическое уравнение которой MgO(тв) + CO(г) = MgCO3(тв) + 102 кДж, вступило 8 г оксида магния. Количество теплоты, выделившейся при этом, равно:
а) 102 кДж б) 204 кДж в) 20,4 кДж г) 1,02 кДж
Ответы (ключ)
| № | |||||||||||||||
| ответ | г | а | в | г | в | а | а | б | а | б | б | в | г | в | в |
Самостоятельная работа № 7
Тема 2.3. Химическая кинетика и катализ
Задания
1. Систематическая проработка конспектов занятий, учебной и специальной химической литературы.
2. Подготовка к практическому занятию с использованием методических рекомендаций преподавателя.
3. Подготовка к лабораторной работе с использованием методических рекомендаций преподавателя.
4. Решение задач по теме "Скорость химической реакции".
5. Составление конспекта по теме: «Кинетика процессов выпечки и сушки пищевых продуктов в общественном питании».
Порядок выполнения задания: решение задач по теме "Скорость химической реакции".
Самостоятельная работа обучающихся:
1. Изучить алгоритм решения задач.
2. Решить предложенные задачи.
Алгоритм решения задач по теме "Скорость химической реакции"
Задача № 1. В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2+ Cl2 = 2HCl, была равна 0,06 моль/л. Через 5 сек концентрация хлора составила 0,02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?
| Дано: | Решение: |
| C1 (Cl2) = 0,06 моль/л C2 (Cl2) = 0,02 моль/л ?t = 5 сек | 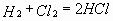 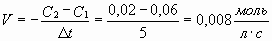 Ответ: V = 0,008 моль/л.с. Ответ: V = 0,008 моль/л.с. |
| V = ? |
Задача № 2. Как изменится скорость протекающей в водном растворе реакции FeCl3 + 3KCNS = Fe(CNS)3+ 3KCl при разбавлении реагирующей смеси водой в два раза?
| Дано: | Решение: |
| C(ионов) < 2 раза | 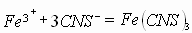 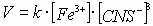 пусть до разбавления пусть до разбавления 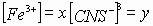 , тогда , тогда 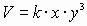 . В результате разбавления концентрация ионов уменьшается: . В результате разбавления концентрация ионов уменьшается: 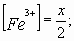 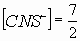 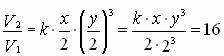 Ответ: Ответ: 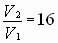 |
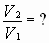 |
Задача № 3. Как изменится скорость реакции при повышении температуры от 55? до 100?С, если температурный коэффициент скорости этой реакции равен 2,5?
| Дано: | Решение: |
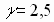 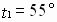 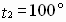 | 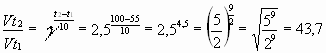 Ответ: скорость реакции увеличивается в 43,7 раза. Ответ: скорость реакции увеличивается в 43,7 раза. |
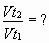 |
Задача № 4. При повышении температуры на 30?С скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции?
| Дано: | Решение: |
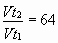 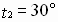 | 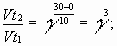 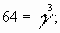 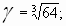 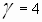 Ответ: температурный коэффициент скорости реакции равен 4. Ответ: температурный коэффициент скорости реакции равен 4. |
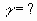 |
Задачи для самостоятельного решения
1. Скорость некоторой реакции про 20 0 С составляет 0,016 моль/л∙с , а при температуре 500 С – 0,128 моль/л∙с. Определите температурный коэффициент данной реакции.
2. При температуре 350 С реакция заканчивается за 1ч 20 мин. Какое время потребуется для завершения реакции при 650 С, если ее температурный коэффициент равен 2?
3. Температурный коэффициент реакции равен 2. На сколько градусов надо уменьшить температуру, чтобы скорость реакции уменьшилась в 16 раз?
4. Как изменится скорость гомогенной химической реакции 2А + В = С , если
Концентрацию вещества А увеличили в 2 раза, концентрация вещества В осталась прежней.
Концентрацию вещества В увеличили в 2 раза, концентрация вещества А осталась прежней.
Концентрацию вещества А увеличили в 3 раза, концентрацию вещества В уменьшили в 6 раз.
Концентрацию вещества А увеличили в 2 раза, концентрацию вещества В уменьшили в 4 раза.
5. Начальная скорость реакции при 400 С составляет 0,54 моль/л∙мин. Вычислите скорость этой реакции при температуре 100 С, если ее температурный коэффициент равен 3.
6. Некоторая масса алюминия растворяется в избытке раствора щелочи при 400 С за 36 минут, а при 300 С – за 1ч 48 мин. Сколько времени потребуется для растворения той же массы алюминия при 600 С при прочих равных условиях?
7. При 100 С реакция протекает за 8 мин., а при 600 С – за 15 сек. Определите температурный коэффициент данной реакции.
8. При температуре 270 С гидролиз сахарозы прошел за 27 минут. За какое время то же количество сахарозы подвергнется гидролизу при температуре 470 С, если температурный коэффициент равен 3?
9. В реакции гидрирования ацетилена до этана концентрацию водорода увеличили в 3 раза, а концентрацию ацетилена уменьшили в 6 раз. Как изменится скорость этой реакции?
10. Как изменится скорость реакции С(ТВ)+2Н2(г)= СН4(г) , если увеличить давление системы в 3 раза?
Порядок выполнения задания: составление конспекта по теме: «Кинетика процессов выпечки и сушки пищевых продуктов в общественном питании». Методические рекомендации по оформлению конспекта представлены в самостоятельной работе № 2.
Самостоятельная работа № 8
